Redoksreaksjoner innebærer overføring av elektroner mellom atomer, ioner eller molekyler.
I en oksidasjonsreduksjonsreaksjon oppstår endringer i oksidasjonsnummeret (nox). Oksireduksjon består av oksidasjons- og reduksjonsprosesser:
- Oksidasjon: resulterer i elektron tap og økt nox.
- Reduksjon: resulterer i elektronforsterkning og redusert nox.
Når ett element gir opp elektroner, vil et annet motta dem. Dermed er det totale antall mottatte elektroner lik det totale antallet tapte elektroner.
Eksempler på redoksreaksjoner på forbrenning, korrosjon og fotosyntese.
Eksempler
Avhengig av elementet som mottar eller donerer elektroner, har vi følgende navn:
- Reduksjonsmiddel: En som gjennomgår oksidasjon forårsaker reduksjon og øker nummeret sitt. Det er det som mister elektroner.
- Oksidasjonsmiddel: Den som gjennomgår reduksjon, forårsaker oksidasjon og reduserte nummeret. Det er det som får elektroner.
O oksidasjonsnummer representerer den elektriske ladningen til et element på det tidspunktet det deltar i en kjemisk forbindelse.
Denne tilstanden er relatert til elektronegativitet, som er tendensen til noen elementer til å motta elektroner.
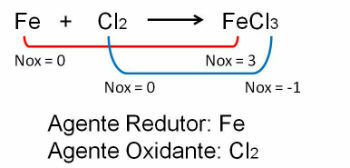
1. Observer det første eksemplet, merk at i reaksjonen mellom jern og klor er det en endring i oksidasjonsnummeret. O klor fordi det er mer elektronegativ, får det elektroner:
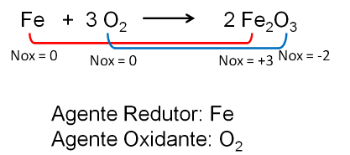
2. Reaksjon mellom jern og oksygen. Oksygen er mer elektronegativ og ender med å motta elektroner og redusere deres oksidasjonsnummer.
Lær mer, les også:
- Oksidasjon
- Forbrenning
- Kjemiske reaksjoner
- elektroner
Trening løst
1. (PUC-RS) I forhold til oksidasjonsligningen - ubalansert reduksjon Fe0 + CuSO4 → Fe2(KUN4)3 + Cu0, kan det sies at:
a) oksidasjonsantal kobber i kobbersulfat er +1.
b) jernatom mister 2 elektroner.
c) kobber gjennomgår oksidasjon.
d) jern er et oksidasjonsmiddel.
e) jern gjennomgår oksidasjon.
Vedtak:
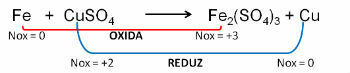
Svare:
e) jern gjennomgår oksidasjon.
Øvelser
1. (UFAC-AC) I følgende kjemiske ligning: Zn + 2 HCℓ → ZnCℓ2 + H2
a) elementet Zn oksyderer og reagerer som et oksidasjonsmiddel.
b) Zn-elementet oksyderer og reagerer som et reduksjonsmiddel.
c) Zn-elementet reduserer og reagerer som et reduksjonsmiddel.
d) HC2 er et reduksjonsmiddel.
e) ligningen er klassifisert som reversibel.
b) Zn-elementet oksyderer og reagerer som et reduksjonsmiddel.
2. (ITA-SP) I den ioniske reaksjonen Ni (s) + Cu2+(aq) → Ni2+(aq) + Cu (s)
a) nikkel er oksidasjonsmiddel fordi det er oksidert.
b) nikkel er reduksjonsmiddel fordi det er oksidert.
c) kobberionet er oksidasjonsmiddel fordi det er oksidert.
d) kobberionet er reduksjonsmiddel fordi det reduseres.
e) det er ikke en redoksreaksjon, derfor er det ingen oksidant eller reduksjonsmiddel.
b) nikkel er reduksjonsmiddel fordi det er oksidert.
3. (UFRGS) Det aktive middelet i husholdningsblekemiddel er hypoklorittionen, ClO-. I blekeprosesser reduseres dette ionet; Dette betyr at:
a) stoffet som gjennomgår virkningen av hypokloritt mottar elektroner.
b) det er en reduksjon i antall elektroner i strukturen.
c) ClO- er et reduksjonsmiddel.
d) ClO- omdannes til elementært klor eller kloridion.
e) ingen elektronoverføring finner sted.
d) ClO- omdannes til elementært klor eller kloridion.
