Det er en gren av vitenskapen som studerer hastigheten på kjemiske reaksjoner og faktorene som påvirker den, den kalles kjemisk kinetikk. Kjemiske reaksjoner kan defineres som et sett med fenomener der to eller flere stoffer reagerer med hverandre og gir opphav til forskjellige forbindelser. En kjemisk ligning er en grafisk fremstilling av en kjemisk reaksjon, der reaktanter vises i det første medlemmet, og produkter i det andre.
A + B.  C + D
C + D
Reagensprodukter
Kunnskapen og studien av reaksjoner, i tillegg til å være veldig viktig i industrielle termer, er også relatert til vårt daglige liv.
Hastigheten til en reaksjon er hvor raskt reaktanter forbrukes eller hvor raskt produkter dannes. Brenning av et lys og dannelse av rust er eksempler på langsomme reaksjoner. I dynamitt er nedbrytningen av nitroglyserin en rask reaksjon.
Hastighetene til kjemiske reaksjoner bestemmes gjennom empiriske lover, kalt love of hastighet, utledet fra effekten av konsentrasjonen av reaktanter og produkter på hastigheten på reaksjon.
Kjemiske reaksjoner oppstår i forskjellige hastigheter, og disse kan endres, fordi i tillegg til konsentrasjon av reaktanter og produkter, avhenger reaksjonshastighetene også av andre faktorer som:
Reagenskonsentrasjon: jo høyere konsentrasjonen av reaktantene er, desto raskere blir reaksjonen. For at en reaksjon skal finne sted mellom to eller flere stoffer, er det nødvendig at molekylene kolliderer, slik at det blir et brudd i bindingene med den påfølgende dannelsen av nye. Antall kollisjoner vil avhenge av konsentrasjonen av A og B. Se bildet:
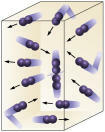
Molekyler kolliderer oftere hvis
vi øker antall reagerende molekyler.
Ikke stopp nå... Det er mer etter annonseringen;)
Det er lett å se at på grunn av en høyere konsentrasjon vil det være en økning i kollisjoner mellom molekyler.
kontaktflate: en økning i kontaktoverflaten øker reaksjonshastigheten. Et eksempel er når vi løser opp en knust sonrisaltablett og den løses opp raskere enn om det var helt, skjer dette fordi vi øker kontaktflaten som reagerer med Vann.
Press: når du øker trykket i et gasssystem, øker reaksjonshastigheten.
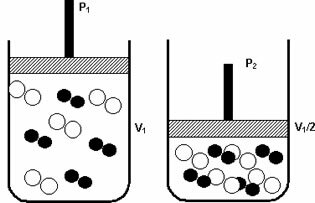
En økning i trykket fra P1 til P2 reduserte volumet fra V1 til V1 / 2, og akselererte reaksjonen på grunn av tilnærmingen til molekylene.
Figuren ovenfor eksemplifiserer, som med reduksjon i volum i den andre beholderen, vil det være en økning i trykk som forsterker kollisjonene av molekylene og som en konsekvens en økning i hastigheten på reaksjon.
Temperatur: når temperaturen i et system økes, er det også en økning i reaksjonshastigheten. Å øke temperaturen betyr å øke kinetisk energi til molekyler. I vår dag til dag kan vi observere denne faktoren når vi lager mat, og vi øker komfyrens flamme slik at maten når graden av matlaging raskere.
Katalysatorer: Katalysatorer er stoffer som akselererer mekanismen uten å bli endret permanent, det vil si under reaksjonen de ikke konsumeres. Katalysatorer lar reaksjonen ta en alternativ vei, som krever mindre aktiveringsenergi, noe som får reaksjonen til å gå raskere. Det er viktig å huske at en katalysator fremskynder reaksjonen, men ikke øker utbyttet, det vil si at den produserer samme mengde produkt, men på kortere tid.
Av Líria Alves
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
SOUZA, Líria Alves de. "Kjemisk kinetikk"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm. Tilgang 27. juni 2021.