I laboratorier og kjemisk industri er det veldig viktig å vite mengden stoffer som er involvert i reaksjonene. Derfor vil vi nedenfor behandle hovedkonseptene, størrelsene og måleenhetene relatert til massene av atomer:
- Atomic Mass Unit (u):
Standardvektreferanseatomet for å betegne atommasseenheten er karbon-12 (12Ç). En atommasseenhet (1 u) tilsvarer verdien av 1.66054. 10-24 g, som er massen på 1/12 av karbonisotopen med en masse lik 12 (12Ç).
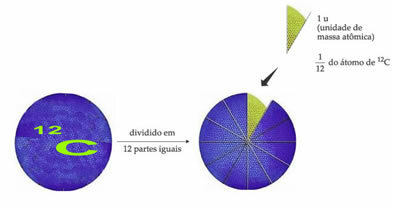
Atommasseenheten (u) er enheten som brukes i alle mengder som er oppført nedenfor.
- Atomic Mass of an Atom or Isotope (MA):
Det oppnås ved å sammenligne det med referanseverdien nevnt i forrige vare. For eksempel atommassen til 919F er gitt av massespektrometeret, som er lik 18,9984 u. Avrunding er den lik 19, som er den samme verdien som massetallet (A). Denne verdien betyr at elementets atommasse 919F er 19 ganger større enn massen på 1/12 av 12Ç.
- Atomic Mass of an Element (AM):
Elementets atommasse bestemmes av det vektede gjennomsnittet av atommassene til dets isotoper. Dette gjøres ved å multiplisere atommassene til hver isotop med prosentandelen som vises i elementets konstitusjon. Disse verdiene blir deretter lagt sammen, som er delt på 100, noe som resulterer i den totale prosentandelen.
Ikke stopp nå... Det er mer etter annonseringen;)
For eksempel er elementet neon sammensatt av tre isotoper med følgende atommasser og prosentandeler i deres konstitusjon:

Beregning av atommassen (MA) for dette elementet:
DÅRLIGneon = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
DÅRLIGneon = 20,179 u
- Molekylær masse (MM):
Som navnet antyder, brukes det til molekylære stoffer, det vil si atomer koblet gjennom en deling av elektronpar, som kalles kovalente bindinger.
Molekylær masse oppnås ved å multiplisere antall atomer til hvert element med deres atommasser og legge sammen resultatene.
For eksempel CO-molekylet2 inneholder ett karbon og to oksygener, så vi multipliserer atommassen av karbon med 1; og oksygen to, og legger dem senere:
MMCO2 = (1. DÅRLIGÇ) + (2. DÅRLIGO)
MMCO2 = (1. 12) + (2. 16)
MMCO2 = 12 + 32
MMCO2 = 44 u
- Masseformel:
Det er den samme beregningen utført for molekylvekt, men for ioniske forbindelser. I dette tilfellet er navnet annerledes, fordi de ikke er gruppert i molekyler, men i klynger av ioner. Ettersom molekyler ikke eksisterer, er det åpenbart ingen mening i å snakke om molekylær masse, men resonnementet bak beregningen er det samme.
Eksempel:
NaCl
↓ ↓
23 +35,5 → Formelmasse = 58,5 u
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Atomsmasser"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm. Tilgang 28. juni 2021.



