DE batteri er et system hvor oksidasjons-reduksjonsreaksjonen finner sted. I denne enheten blir den kjemiske energien som produseres i den spontane reaksjonen omdannet til elektrisk energi.
Oksidasjons- og reduksjonsreaksjoner skjer samtidig i en celle. Når en art gjennomgår oksidasjon, donerer den elektroner til den andre arten, som ved mottak av dem gjennomgår reduksjon.
Derfor er den som gjennomgår oksidasjon reduksjonsmidlet og den som gjennomgår reduksjon er oksidasjonsmidlet.
DE oksidasjon oppstår når en art mister elektroner og blir en kation: A → A+ + og-.
DE reduksjon oppstår når en art får elektroner og blir elektrisk nøytral: B+ + og- → B.
I de kjemiske ligningene, dette elektronoverføring vises ved endringen i oksidasjonstallet (nox).
Reduksjonsreaksjoner skjer inne i cellene og den elektriske strømmen oppstår ved migrering av elektroner fra den negative til den positive polen.

Hvordan fungerer en stabel?
En redoksreaksjon kan generelt representeres av ligningen:
A + B+ → A+ + B
Hvor,
A: stoff som oksideres, mister elektroner, øker verdien og er reduksjonsmiddel.
B: stoff som gjennomgår reduksjon, får elektroner, reduserer oksidasjon og er oksidasjonsmiddel.
Se i det følgende bildet hvordan denne prosessen kan representeres.
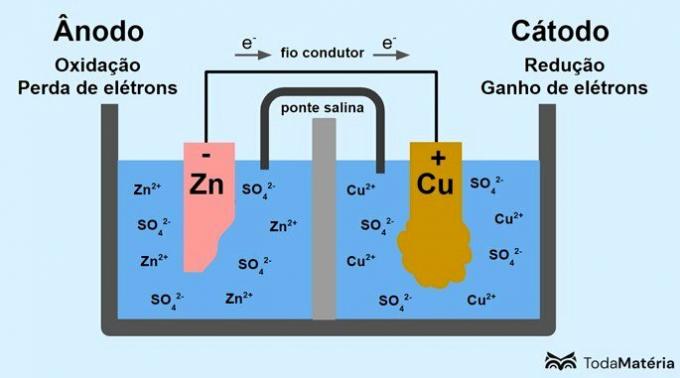
Systemet delt inn i to halvceller og dannet av to metalliske elektroder koblet eksternt med en ledende ledning ble utviklet av John Frederic Daniell (1790-1845) i 1836.
Batteriet består av to elektroder, forbundet med en ledende ledning, og en elektrolytt, der ionene er. Elektroden er den solide ledende overflaten som tillater utveksling av elektroner.
anode: elektrode der oksidasjon skjer. Det er også den negative polen til batteriet.
Katode: elektrode der reduksjonen skjer. Det er også den positive polen til batteriet.
På bildet ovenfor er metallisk sink anoden og gjennomgår oksidasjon. Metallisk kobber er katoden og gjennomgår reduksjon. Migrasjonen av elektroner (e-) skjer fra anoden til katoden gjennom den ledende ledningen.
Reaksjonene som oppstår i bildesystemet er:
- anode (oksidasjon): Zn(s) → Zn2(her) + 2e-
- Katode (reduksjon): Cu2+(her) + 2e- → ass(s)
- generell ligning: Zn(s) + ass2+(her) → ass(s) + Zn2+(her)
Sink er et metall med større tendens til å miste elektroner, og derfor dannes kationer i løsningen. Sinkelektroden begynner å slites ut og taper masse fordi sink frigjøres til løsning når det dannes Zn-kationer2+.
Elektronene fra anoden kommer til katoden og metallkationene, ved mottak av dem, omdannes til metallisk kobber, som avsettes på elektroden og øker massen.
Saltbroen er en ionestrøm som er ansvarlig for sirkulasjonen av ioner i systemet for å holde det elektrisk nøytralt.
Les også om oksidasjonstall (nox).
batterityper
I en celle bestemmes tendensen til kjemiske arter til å motta eller donere elektroner av reduksjonspotensialet.
Komponenten med høyest reduksjonspotensial har en tendens til å gjennomgå reduksjon, det vil si å få elektroner. Arten med det laveste reduksjonspotensialet og følgelig det høyeste oksidasjonspotensialet har en tendens til å overføre elektroner.
For eksempel, i redoksreaksjonen Zn0(s) + ass2+(her) → ass0(s) + Zn2+(her)
Sink oksiderer og donerer elektroner fordi det har et reduksjonspotensial E0 = -0,76V, mindre enn reduksjonspotensialet til kobber E0 = +0,34V og derfor mottar den elektroner og gjennomgår reduksjon.
Se nedenfor for andre eksempler på stabler.
Sink og hydrogen stabel
Oksidasjonshalvreaksjon: Zn(s) → Zn2+ + 2e- (OG0 = -0,76V)
Reduksjonshalvreaksjon: 2H+(her) + 2e- → H2(g) (OG0 =0,00V)
Global ligning: Zn(s) + 2H+(her) → Zn2+(her) + H2(g)
Stabelrepresentasjon:
Kobber- og hydrogencelle
Oksidasjonshalvreaksjon: H2(g) → 2H+(her) + 2e- (OG0 = 0,00V)
Reduksjonshalvreaksjon: Cu2+(her) + 2e- → ass(s) (OG0 = +0,34V)
Global ligning: Cu2+(her) + H2(g) → 2H+(her) + ass(s)
Stabelrepresentasjon:
Få mer kunnskap om emnet med innholdet:
- elektrokjemi
- Elektrolyse
Bibliografiske referanser
FONSECA, M. R. M. Kjemi, 2. 1. utg. São Paulo: Attica, 2013.
SANTOS, W.L.P; MOL, G.S. Innbyggerkjemi, 3. 2. utg. São Paulo: Editora AJS, 2013.
USBERCO, J. Koble sammen kjemi, 2: kjemi. - 2. utg. São Paulo: Saraiva, 2014.


