Karbonater er uorganiske forbindelser dannet ved ionebinding av et metall eller semimetall med karbonatanionet, CO32-.
Karbon er tetravalent, det vil si at det har fire elektroner i valensskallet, og det kan lage fire kovalente bindinger for å være stabile, mens oksygen er toverdig, har seks elektroner i valensskallet og er i stand til å lage to bindinger for å være stabile, med åtte elektroner. Dermed er det en sterk tendens til at et karbon binder seg til to oksygenatomer, som alle er stabile (O ═ C ═ O → CO2).
Men annet oksygen kan kombineres med karbon, siden forholdet mellom ioniske radier fører til et koordinasjonstall som er lik 3, og danner en struktur trekantet hvor karbonet er i sentrum, og danner en dobbeltbinding med et av oksygenatomene og to enkeltbindinger med de to andre oksygener. Resultatet er to overskytende elektroner, siden disse to oksygene ikke er stabile og trenger å motta ett elektron hver:
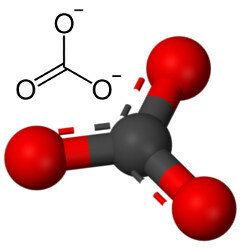
Karbonatanionen dannes av kovalente bindinger, men forbindelsene er uorganiske salter og mineraler kjent som karbonater, er ioniske, da denne radikalen mottar to elektroner fra noe metall eller halvmetall og danner et ionisk binding.
Disse forbindelsene er uoppløselige i vann, med unntak av ammoniumkarbonat ((NH4)2CO3) og karbonater dannet med alkalimetaller (grunnstoffer i familie 1: Li, Na, K, Rb, Cs og Fr). Nesten alle er hvite faste stoffer, som vist på bildet nedenfor:

De to vanligste og viktigste hverdagseksemplene på karbonater er natriumkarbonat (Na2CO3) og kalsiumkarbonat (CaCO3). I det første tilfellet tilhører natrium familie 1, med et elektron i valensskallet og har en tendens til å miste dette elektronet for å bli stabilt. Ettersom karbonatanionen trenger å motta to elektroner, binder den seg til to natriumatomer:
Ikke stopp nå... Det er mer etter annonseringen;)

Soda er bedre kjent som brus eller brus, og brukes til fremstilling av såper, fargestoffer, medisiner, papirer og i behandling av bassengvann. Men hovedapplikasjonen er med kalsiumkarbonat og sand ved fremstilling av glass.
Kalsium er familie 2, og har en tendens til å miste to elektroner. Dermed binder et kalsiumatom seg til et karbonatradikal:

Kalsiumkarbonat er tilstede i kalkstein og marmor. På stalaktitter og stalagmitter som finnes i huler, består av dette karbonatet; skjell, korallrev og eggeskall også. Når vi kalker vegger, trestammer og andre steder, bruker vi kalsiumhydroksid (Ca (OH)2), som over tid reagerer med atmosfærisk karbondioksid og danner kalsiumkarbonat.

Karbonater er veldig vanlige på jordoverflaten, som i tilfelle mineraler. Dens krystallinske retikulum kan omorganisere seg i rommet på to måter: det ortorhombiske (som er tilfellet med mineralet aragonitt vist ovenfor sammen med kalsiumkarbonatformelen) og rombohedral eller trigonal, som det er tilfellet med kalsitt (et annet mineral som består av kalsiumkarbonat).
Karbonater reagerer i nærvær av syrer og frigjør CO2, som lett sees gjennom brus.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Karbonater"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/carbonatos.htm. Tilgang 28. juni 2021.
Kjemi

Natriumkarbonat, Leblanc-metoden, Ernest Solvay-metoden, brus, brus, vanlig glassproduksjon, vannbehandling av svømmebasseng, vann-pH-kontroll, tekstilbehandling, tilsetningsstoff.
Kjemi

Hverdagssalter, kalsiumkarbonat, natriumklorid, natriumfluorid, kaliumnitrat, natriumnitrat natrium, natriumkarbonat, natriumbikarbonat, natriumbikarbonat, natriumsulfitt, saltpeter, soda.