O beregne antall atompartikler brukes til å indikere mengden protoner (i kjernen), elektroner (i elektrosfæren) og nøytroner (i kjernen) som er tilstede i ethvert atom eller ion. For å gjøre dette er det viktig å kjenne til noen egenskaper ved atomer:
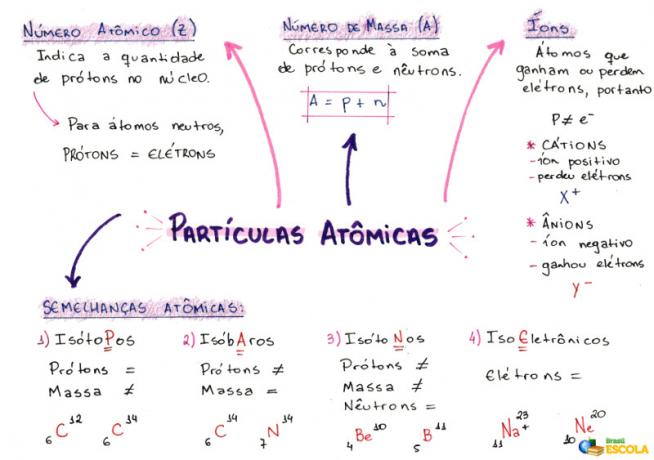
1- Atomnummer (Z)
Det er en matematisk kode, representert med store bokstaver Z, plassert på nedre venstre side av et atoms forkortelse:
ZX
Det indikerer antall protoner (p) i kjernen og antall elektroner (e) i et atoms elektrosfære. Så generelt sett:
Z = p = e
2- Massetall (A)
Det er en matematisk kode som tilsvarer summen av antall protoner (p) og nøytroner (n), begge til stede i kjernen til ethvert atom. Ligningen som representerer massetallet er gitt av:
A = p + n
Siden antall protoner er lik atomnummeret, kan vi skrive ligningen for å beregne massetallet som følger:
A = Z + n
Hvis vi vet massetallet og atomnummeret til et atom, kan vi bestemme antall nøytroner som følger:
n = A - Z
3- ioner
De er atomer som mister eller får elektroner. De har et positivt eller negativt tegn plassert øverst til høyre i representasjonen, som i følgende modell:
X+ eller X-
Positivt ion: Dette kalles et kation, og det positive tegnet indikerer at det har mistet elektroner.
Negativt ion: Dette kalles et anion, og det negative tegnet indikerer at det har fått elektroner.
Ikke stopp nå... Det er mer etter annonseringen;)
4- Atomiske likheter
a) Isotoper
Atomer som har samme atomnummer og forskjellige massetall. Eksempel:
7X14 og 7Y16
Atomer X og Y har samme atomnummer (til venstre for akronymet), det vil si lik 7. Atom X har et massetall (til høyre for akronymet) lik 14, og atom Y har et massetall lik 16.
b) Isobarer
Atomer som har samme massetall og forskjellige atomnumre. Eksempel:
15X31 og 13Y31
Atomer X og Y har et massetall (til høyre for akronymet) lik 31. Atom X har derimot et atomnummer som er lik 15, og atom Y har et atomnummer som er lik 13.
c) Isotoner
Atomer som har forskjellige massetall og atomnummer, men samme antall nøytroner.
d) Isoelektronikk
Atomer som har samme antall elektroner. Eksempel:
12X+2 og 7Y-3
Atom X har et atomnummer lik 12 og er et kation (med en positiv ladning +2), så det mister to elektroner, og har dermed 10 elektroner i sin elektrosfære. Atom Y, derimot, har et atomnummer lik 7 og er et anion (med negativ ladning -3), så det får tre elektroner, og har dermed 10 elektroner i sin elektro-sfære.
Mind Map: Atomic Particles
* For å laste ned tankekartet i PDF, Klikk her!
Eksempler på beregning av antall atompartikler
Eksempel 1: Bestem antall protoner, nøytroner og elektroner i atomet 14X29.
Følgende verdier for atom X ble gitt:
Massetall (øverst til høyre) = 29
Atomnummer (nede til venstre) = 14
For å bestemme antall protoner:
Antall protoner er alltid lik atomnummeret, så X-atomet har 14 protoner.
For å bestemme antall elektroner:
Siden atom X ikke er et ion, er antallet elektroner lik antall protoner, det vil si 14.
For å bestemme antall nøytroner:
Antall nøytroner bestemmes ved hjelp av antall masse og protoner i følgende formel:
A = p + n
29 = 14 + n
29 - 14 = n
n = 15
Eksempel 2: Bestem antall protoner, nøytroner og elektroner til ion X+3, vel vitende om at deres massetall og atomnummer er henholdsvis 51 og 23.
Følgende verdier for ion X ble gitt:
Massetall = 51
Atomnummer (nede til venstre) = 23
For å bestemme antall protoner:
Antall protoner er alltid lik atomnummeret, så X-atomet har 23 protoner.
For å bestemme antall elektroner:
Ionen X er positiv (+3), så det er et kation som har mistet tre elektroner. Så antallet elektroner er 20.
MERK: Reduksjonen eller økningen i antall elektroner skjer alltid i forhold til atomnummeret.
For å bestemme antall nøytroner:
Antall nøytroner bestemmes ved hjelp av antall masse og protoner i følgende formel:
A = p + n
51 = 23 + n
51 - 23 = n
n = 28
Eksempel 3: Et atom W har et atomnummer og masse lik henholdsvis 29 og 57, idet det er isobar av a atom Y, som har et atomnummer lik 30, som er isotopen til et atom B, hvis massetall er 65. Med denne informasjonen bestemmer du antall protoner, nøytroner og elektroner i atom B.
Data gitt av øvelsen:
Atom W.
atomnummer (nede til venstre) = 29
massetall (øverst til høyre) = 57
Y isobar, dvs. massen av Y er også 57.
Y-atom
atomnummer = 30
massetall = 57
Med disse to verdiene, må vi bestemme nøytrontallet, fordi det er isoton av element B:
A = Z + n
57 = 30 + n
57 - 30 = n
n = 27
Atom B:
massetall = 65
antall nøytroner = 27
Med disse dataene må vi bestemme atomnummeret, for med det vil vi bestemme antall protoner og antall elektroner (siden det ikke er et ion):
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
Derfor har atomet B 38 protoner, 38 elektroner og 27 nøytroner.
* Mind Map av Victor Ricardo Ferreira
Kjemilærer
Av meg. Diogo Lopes Dias