Als het mogelijk zou zijn om de structuur van een metaal heel duidelijk te visualiseren, zouden we het zien zoals in de afbeelding hierboven. De atomaire structuur van metalen is Kristallijn, dat bestaat uit metaalkationen omgeven door elektronen.
De kristalroosters die in metalen aanwezig zijn, kunnen als volgt worden weergegeven: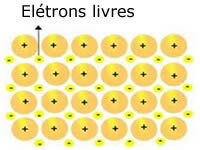
Vertegenwoordiging van metallisch natrium (Na)
De kristalroosters van metalen worden gevormd door een groep vaste kationen.
Elk Na+-kation is omgeven door elektronen, maar deze zijn gedelokaliseerd, dat wil zeggen dat ze door geen enkele kern worden aangetrokken.
Omdat er geen aantrekkingskracht is tussen negatieve ladingen (elektron) en de positieve kern (kation), bezetten de vrije elektronen uiteindelijk het gehele kristalrooster van het metaal. De vrijheid die elektronen hebben om te bewegen zorgt ervoor dat ze een elektronische wolk vormen.
Het vermogen van metalen om elektriciteit te geleiden wordt verklaard door de aanwezigheid van deze wolk. Elektrische stroom ontstaat door het contact van vrije elektronen met andere metalen.
In de samenstelling van elk atoom, inclusief metalen zoals Natrium (Na), Goud Au, Koper (Cu), is er een valentielaag. Elektronen bewegen vrij door deze laag en behouden de elektromagnetische aantrekkingskracht voor kationen. Deze structurele eigenschap maakt de vorming van metallische moleculen mogelijk en bijgevolg van de metalen zelf.
Door Liria Alves
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/como-se-forma-ligacao-metalica.htm