Wanneer we thuis voedsel koken, gebruiken we kookgasverbranding. Een van de dingen die we kunnen zien aan de vlam die ontstaat door de verbranding van dit gas, is dat de kleur normaal gesproken heel lichtblauw is. Bij de meeste verbrandingsreacties, zoals het branden van een kaars, is de vlam echter geel van kleur.

Dan rijst de vraag:
"Als elke brand het gevolg is van een verbrandingsreactie, waarom hebben sommige vlammen dan verschillende kleuren?"
Om te begrijpen hoe dit gebeurt, moeten we begrijpen wat een verbrandingsreactie is en welke stoffen in elk van de genoemde reacties aanwezig zijn.
Een verbrandingsreactie treedt op wanneer een brandstof (oxideerbaar materiaal) wordt verbruikt door een oxidatiemiddel (een gasvormig materiaal dat zuurstof bevat) om thermische energie (warmte) te genereren.
Een ander belangrijk punt dat we moeten weten over verbrandingsreacties is dat ze kunnen optreden in een compleet of onvolledig. Als er voldoende zuurstof is om de brandstof te verbruiken, zal de reactie voltooid zijn en kooldioxide (CO
2) en water (H2O). Anders zal de verbranding gedeeltelijk en onvolledig zijn, waarbij koolmonoxide (CO) en water worden gegenereerd; of koolstof (C) en water.In beide gevallen analyseren we, de oxidator is de zuurstof die in de lucht aanwezig is. Brandstof is echter anders. Kookgas is eigenlijk vloeibaar petroleumgas (LPG), een mengsel van koolwaterstoffen (alkanen), waarvan butaan (C) de belangrijkste brandstof is.4H10). Kookgas bestaat dus uit alkaanmoleculen die alleen drie of vier koolstofatomen, daarom is er weinig zuurstof nodig om de verbranding volledig te laten plaatsvinden. Deze reactie kan als volgt worden uitgedrukt:
1C4H10 (g) + 13/2 O2(g) → 4 CO2(g) + 5 uur2O(g), ∆H < 0
In het geval van kaarsen is de paraffine de brandstof voor de reactie en bestaat deze uit een mengsel van alkanen met koolstofatomen die bereik van 20 tot 36. Daarbij, er is veel meer zuurstof nodig om deze reactie volledig te laten plaatsvinden. Zie een voorbeeld:
1C24H50(en) + 70/2 O2(g) → 25 CO2(g) + 25 H2O(g), ∆H < 0
In de lucht is niet genoeg zuurstof om deze volledige verbranding uit te voeren, dus vindt deze onvolledig plaats, zoals hieronder weergegeven:
1C24H50(en) +49/2 O2(g) → 24 CO(g) + 25 H2O(g), ∆H < 0
1C24H50(en) +25/2 O2(g) → 24C(en) + 25 H2O(g), ∆H < 0
Onvolledige reacties produceren minder energie dan volledige verbranding. Dit verklaart het verschil tussen de kleuren van de vlammen, aangezien de gele vlam, kenmerkend voor onvolledige verbranding, een lagere energie heeft. De blauwe vlam is kenmerkend voor een volledige verbranding, met meer energie.
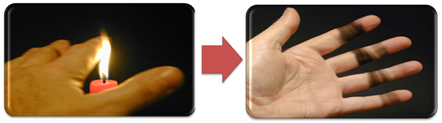
Dit verklaart ook de vorming van roet door de kaarsvlam (hieronder afgebeeld), wat koolstof wordt beschouwd als het product van onvolledige verbranding.
Maar waarom is het bij de bunsenbrander mogelijk om gele en blauwe vlammen te krijgen als de brandstof niet verandert?
In het geval van de bunsenbrander wordt dit bereikt door de toevoer van gas en lucht te regelen. Als het raam gesloten is, waardoor een kleine hoeveelheid lucht binnenkomt, zal de verkregen vlam geel zijn, omdat deze weinig zuurstof zal hebben om volledige verbranding uit te voeren. Als de regeling van het gas-luchtmengsel voldoende is, krijgen we een blauwe vlam.
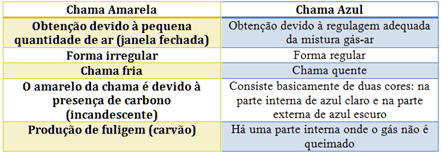
Zie de kenmerken van elk in de onderstaande tabel:
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm