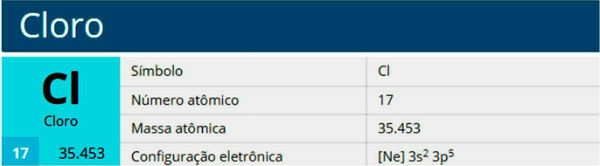
Chloor is een scheikundig element met het symbool Cl, atoomnummer 17, atoommassa 35,5. Het behoort tot de halogeenfamilie, groep 17 of 7A, en tot de derde periode van het periodiek systeem.
De naam is afgeleid van het Grieks khloros, wat groenachtig betekent. Dit komt omdat chloor onder normale omstandigheden van temperatuur en druk wordt gekenmerkt door een groenachtig geel gas met een sterke geur.
Kenmerken
Chloor werd in 1774 ontdekt door de Zweedse wetenschapper Carl Wilhelm Scheele (1742-1786). In die tijd geloofde ik echter dat het een verbinding met zuurstof was. In 1810 toonde Humphry Davy (1778-1829) aan dat het een nieuw chemisch element was.
Omdat het een extreem reactief element is, wordt het in zijn pure vorm nauwelijks in de natuur aangetroffen, met uitzondering van de kleine hoeveelheid die tijdens vulkaanuitbarstingen in de vorm van HCl wordt uitgestoten.
Het wordt dus vaak aangetroffen in de vorm van natriumchloride (NaCl), ook wel keukenzout genoemd. In mineralen komt het voor in de vorm van carnalliet en sylviet.
Het kan ook worden verkregen door elektrolyse van NaCl, in waterige oplossing. Chloor produceert ook veel zouten uit chloriden door het proces van: oxidatie.
Lees meer, lees ook:
- Periodiek systeem
- Chemische elementen
- Halogenen
toepassingen
Chloorgas (Cl2) is giftig en irriterend, deze toestand leidde ertoe dat het tijdens de 1e Wereldoorlog als chemisch wapen werd gebruikt. Dit gas veroorzaakt irritatie in de luchtwegen en de huid, vochtophoping in de longen, tranenvloed en kan bij inademing in grote hoeveelheden tot de dood leiden.
Enkele andere toepassingen van chloor zijn:
- Bleken van papier en textiel met chloordioxide (ClO2).
- Waterbehandeling, de toevoeging van chloor maakt het water drinkbaar en geschikt voor menselijke consumptie. Dit proces wordt chlorering genoemd en maakt gebruik van hypochloorzuur (HClO).
- Desinfectie van zwembadwater en industrieel afval, aangezien chloor micro-organismen kan doden.
- Productie van kunststofverbindingen zoals PVC (polyvinylchloride) en synthetisch rubber.
- Productie van sommige soorten organische en anorganische verbindingen.