Experimenten zijn een praktische manier om uw kennis van de in scheikunde bestudeerde concepten te leren en te testen.
Profiteer van deze chemische experimenten, die je thuis (onder toezicht van een volwassene) kunt doen of in de klas met de leraar kunt doen, als aanvulling op je studie.
1e ervaring - het ontrafelen van de kleuren
Betrokken concepten: chromatografie en scheiding van mengsels
Materialen
- pennen (markers) van verschillende kleuren
- alcohol
- koffie filterpapier
- beker (glas om de monitoring van het experiment te vergemakkelijken)
Hoe te maken
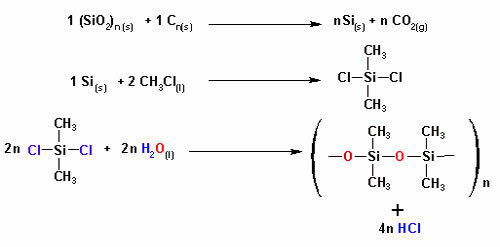
- Gebruik een schaar en knip stroken filterpapier. Maak voor elke gebruikte pen een rechthoek.
- Teken nu op een afstand van ongeveer 2 cm van de basis een cirkel met de door u gekozen kleurpen en schilder de binnenkant.
- Lijm de rand van het papier het verst van de getekende knikker op een steun. Hiervoor kunt u een tape gebruiken en deze aan een potlood bevestigen.
- Voeg alcohol toe aan de beker, niet te veel, want het moet net het uiteinde van het papier bij de penmarkering raken.
- Plaats het papier in de beker zodat het verticaal staat. Het potlood dat het ondersteunt, moet op de randen rusten.
- Wacht tussen de 10 en 15 minuten totdat de alcohol door het filterpapier is gestegen. Verwijder daarna de papieren en laat ze drogen.
Resultaat
Wanneer alcohol door de penmarkering gaat, interageert het met de kleurcomponenten en drijft ze over het papier. Zo worden de verschillende pigmenten gescheiden door contact met alcohol.
Door dit experiment is het mogelijk om te weten welke kleuren werden gemengd om de kleur van de pen te creëren.
Uitleg
Chromatografie is een soort proces voor het scheiden van mengsels. Filterpapier is de stationaire fase en alcohol is de mobiele fase die de componenten van het mengsel meesleept terwijl het door de stationaire fase gaat. In dit proces, hoe groter de interactie met de alcohol, hoe sneller het pigment zal bewegen met de passage van het oplosmiddel.
De bestanddelen van het materiaal, omdat ze verschillende eigenschappen hebben, zullen interageren met de mobiele fase op verschillende manieren, wat te merken is aan de verschillende sleeptijden in de stationaire fase.
Leer meer over chromatografie.
2e ervaring - voedselconservering
Betrokken concepten: organische verbindingen en chemische reacties
Materialen
- appel, banaan of peer
- citroen of sinaasappelsap
- Vitamine C-tablet
Hoe te maken
- Kies een van de drie vruchten en snijd deze in 3 gelijke delen.
- Het eerste stuk zal dienen als een vergelijking met de anderen. Voeg er dus niets aan toe, maar laat het gewoon aan de lucht staan.
- Druppel in een van de stukjes de inhoud van een citroen of een sinaasappel. Verspreid zodat de hele binnenkant van het fruit bedekt is met sap.
- Verspreid in het laatste deel de vitamine C, het kan een verpulverde tablet zijn, over het vruchtvlees.
- Kijk wat er gebeurt en vergelijk de resultaten.
Resultaat
Het vruchtvlees van het fruit dat aan de lucht is blootgesteld, moet snel donker worden. Citroen- of sinaasappelsap en vitamine C, een chemische stof die ascorbinezuur wordt genoemd, zouden het bruin worden van de vrucht moeten vertragen.

Uitleg
Wanneer we een vrucht snijden, worden de cellen beschadigd, waardoor enzymen zoals polyfenoloxidase vrijkomen, die in contact met de lucht oxideren de fenolische verbindingen die in het voedsel aanwezig zijn en veroorzaken een enzymatische bruining.
Om de werking van zuurstof te voorkomen, worden conserveermiddelen zoals ascorbinezuur gebruikt omdat ze bij voorkeur worden geoxideerd in plaats van fenolische verbindingen. Naast de vitamine C-tablet is ascorbinezuur ook aanwezig in natuurlijke bronnen, zoals citrus, citroen en sinaasappel, gesuggereerd in het experiment.
Leer meer over oxidatie.
3e ervaring - wie bevriest sneller?
Betrokken concepten: colligatieve eigenschappen en cryoscopie
Materialen
- twee buizen (gebruikt voor feestartikelen)
- glazen kom
- tafel zout
- gefilterd water
- ijs-
- thermometer
Hoe te maken
- Voeg dezelfde hoeveelheid gefilterd water toe aan beide buizen. Bijvoorbeeld 5 ml in elke buis.
- Voeg het tafelzout toe aan een van de buisjes en plaats een identificatietape om te zien welke zout is.
- Vul de glazen container met gemalen ijs en voeg wat zout toe.
- Plaats de twee buizen tegelijkertijd in het ijs en kijk wat er gebeurt.
- Noteer de vriestemperatuur voor elke situatie.
Resultaat
Het toevoegen van een opgeloste stof aan water verlaagt de vriestemperatuur. Daarom heeft gewoon water de neiging veel sneller te bevriezen dan een zout- en wateroplossing wanneer het aan dezelfde omstandigheden wordt blootgesteld.
Uitleg
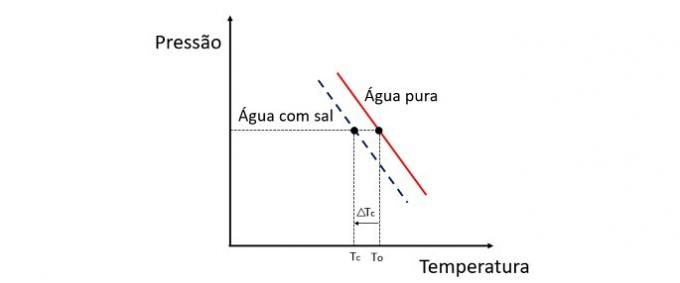
Cryoscopie is een colligatieve eigenschap die de variatie in de temperatuur van een oplosmiddel bestudeert wanneer verschillende hoeveelheden opgeloste stof erin worden opgelost.
Het verlagen van de vriestemperatuur van water wordt veroorzaakt door een niet-vluchtige opgeloste stof en dit fenomeen heeft veel praktische toepassingen. Daarom beïnvloedt hoe groter de concentratie van opgeloste stof in de oplossing het cryoscopische effect.
Als bijvoorbeeld water bevriest bij 0 °C en we er zout aan toevoegen, zal de faseovergangstemperatuur negatief zijn, dat wil zeggen veel lager.
Dit is de reden waarom zeewater niet bevriest op plaatsen waar de temperatuur lager is dan 0°C. Zout opgelost in water heeft de neiging om de vriestemperatuur verder te verlagen. Op plaatsen waar sneeuw ligt, is het ook gebruikelijk om zout op de wegen te strooien om het ijs te smelten en ongelukken te voorkomen.
Leer meer over colligatieve eigenschappen.
4e experiment - ontleding van waterstofperoxide
betrokken concepten: chemische reactie en katalysator
Materialen
- Half rauwe aardappel en half gekookt
- Een stuk rauwe lever en nog een gekookt stuk
- Waterstof peroxide
- 2 gerechten
Hoe te maken
- Voeg in elk gerecht voedsel, aardappelen en levers samen.
- Voeg in elk van de vier materialen 3 druppels waterstofperoxide toe.
- Kijk wat er gebeurt en vergelijk de resultaten.
Resultaat
Waterstofperoxide, een waterstofperoxide-oplossing, begint vrijwel onmiddellijk te bruisen wanneer het in contact komt met rauw voedsel.
Dit experiment kan ook worden gedaan door een stuk voedsel toe te voegen aan een container met waterstofperoxide om de reactie meer merkbaar te maken.
Uitleg
Het bruisen van waterstofperoxide bij contact met rauw voedsel kenmerkt de foods optreden van een chemische reactie, namelijk de ontleding van waterstofperoxide en het vrijkomen van het gas zuurstof.
De ontleding van waterstofperoxide vindt plaats door de werking van het katalase-enzym, gevonden in de peroxisomen-organel, aanwezig in dierlijke en plantaardige cellen.
Het is belangrijk om te benadrukken dat de ontleding van waterstofperoxide spontaan plaatsvindt, in aanwezigheid van zonlicht, maar in een zeer langzame reactie. Katalase werkt echter als een katalysator, waardoor de snelheid van de chemische reactie toeneemt.
Waterstofperoxide kan een giftige stof zijn voor cellen. Daarom breekt katalase de verbinding af en produceert water en zuurstof, twee stoffen die het lichaam niet schaden.
Wanneer voedsel wordt gekookt, ondergaan de componenten veranderingen. De modificaties die door koken worden veroorzaakt, brengen ook de werking van katalase in gevaar door het eiwit te denatureren.
Dezelfde actie die we zien met voedsel is wat er gebeurt als we waterstofperoxide op een wond smeren. Catalase werkt en er is de vorming van bellen, die bestaat uit het vrijkomen van zuurstof.
Leer meer over chemische reacties.
Bibliografische verwijzingen
HEILIGEN, W. L. P.; MOL, G. S. (Coördinaten.). Burger scheikunde. 1. red. São Paulo: nieuwe generatie, 2011. v. 1, 2, 3.
BRAZILIAANSE CHEMISCHE SAMENLEVING (org.) 2010. Scheikunde bij jou in de buurt: goedkope experimenten voor het K-12-klaslokaal. 1. red. So Paulo.