Atomen zijn oneindig kleine deeltjes die alle materie in het universum vormen. In de loop van de tijd veranderde het idee van hoe de atomaire structuur eruit zou zien volgens nieuwe ontdekkingen van wetenschappers. Meer hierover lees je in de tekstEvolutie van het atoommodel.
Een model is een weergave van de werkelijkheid (niet de werkelijkheid zelf), dus atomaire modellen zijn representaties van hoofdcomponenten van het atoom en zijn structuur en verklaren bepaalde fysische en chemische gedragingen van materie. Dit wordt gedaan omdat het voor een mens nog niet mogelijk is om een geïsoleerd atoom te zien, zelfs niet met ultramicroscopen.
Om een idee te krijgen van hoe klein het atoom is, weet dat De Het kleinste deeltje dat zichtbaar is onder een gewone microscoop bevat meer dan tien miljard atomen! Het atoom is zo klein dat, als we er een miljoen naast elkaar zouden leggen, zouden we de niet bereiken dikte van een haar.
Mindmap: Atoom
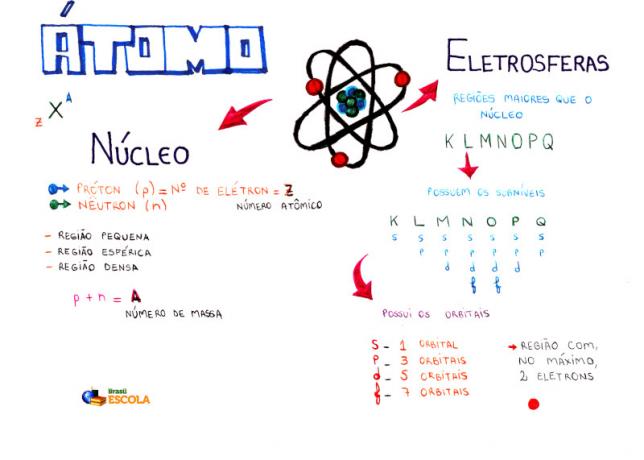
* Om de mindmap in PDF te downloaden, Klik hier!
Van de atoommodellen is het Rutherford-Bohr-model het meest gebruikt op de middelbare school om de structuur van het atoom en zijn eigenschappen te begrijpen. Volgens dit model bestaat de structuur van het atoom uit twee hoofdonderdelen:
kern en de elektrosfeer.
Twee hoofdonderdelen van de structuur van een atoom - elektrosfeer en kern
* Kern: Het vormt het centrale deel van het atoom en is compact, massief en zeer dicht, naast dat het wordt gevormd door deeltjes met een grotere massa, die protonen en neutronen zijn.

Illustratie van de protonen en neutronen waaruit de atoomkern bestaat
- Protonen: het zijn positief geladen deeltjes (relatieve lading = +1; lading in coulomb (C) = +1,602. 10-19) en de relatieve massa is gelijk aan 1.
Het feit dat protonen de kern vormen en deze een algehele positieve lading geven, werd ontdekt door Eugen Goldstein, in 1886, door een wijziging in de ampul van Crookes en enkele experimenten. Hij zag dat er onder zeer hoge spanningen emissies ontstonden (anodestralen - overblijfselen van atomen van het gas dat zich in de lamp bevond en waarvan de elektronen door de elektrische ontlading waren afgerukt). Door een elektrisch of magnetisch veld buiten de lamp te plaatsen, werden deze stralen afgebogen naar de negatieve pool. Dit betekende dat er positieve subatomaire deeltjes waren, die protonen werden genoemd.
Later, Ernest Rutherford (1871-1937) voerden het experiment uit dat in de tekst wordt beschreven Het atoom van Rutherford, waardoor hij de locatie van het proton ontdekte: in de kern.
- Neutronen: het zijn deeltjes met een massa gelijk aan die van protonen (1), maar zoals de naam al aangeeft, zijn ze neutraal, dat wil zeggen dat ze geen elektrische lading hebben.
Neutronen werden in 1932 ontdekt door James Chadwick (1891-1974), die zich realiseerde dat de kern van radioactief beryllium neutrale deeltjes uitzond met een massa die ongeveer gelijk is aan de massa van protonen (eigenlijk is deze iets groter).
Niet stoppen nu... Er is meer na de reclame ;)
De diameter van de kern hangt af van de hoeveelheid protonen en neutronen die het atoom heeft, maar gemiddeld is het ongeveer 10-14 maand en 10-15 m.
De atoomkern concentreert praktisch de gehele massa van het atoom, zijnde een heel klein deel: zowel het proton als het neutron zijn ongeveer 100.000 keer kleiner dan het hele atoom zelf! Stel je ter vergelijking voor dat we de kern van het atoom van het element waterstof vergroten (dat alleen een proton) ter grootte van een tennisbal, zou het dichtstbijzijnde elektron ongeveer drie kilometer verwijderd zijn van afstand! Zelfs als een atoom zou worden vergroot tot de hoogte van een gebouw van 14 verdiepingen, zou de kern ervan zo groot zijn als een zoutkorrel op de zevende verdieping. Het is echt iets geweldigs, vind je niet?!
* Elektrosfeer: Is gebied waar elektronen rond de kern draaien. Ondanks dat het een gebied is met een veel groter volume dan de kern, is het praktisch leeg, aangezien elk elektron 1836 keer kleiner is dan 1 proton (of dan 1 neutron). Daarom bevindt de massa van het atoom zich praktisch geheel in de kern. Elektronen zijn deeltjes met een negatieve elektrische lading (-1).
Elektronen werden in 1897 ontdekt door Joseph John Thomson (1856-1940), de maker van Thomson atoommodel. Thomson's experiment is in detail te zien in de tekst Thomson's experiment met elektrische ontladingen, maar kortom, hij gebruikte de eerder genoemde Crookes-ampul en realiseerde zich dat kathodestralen altijd waren aangetrokken door de positieve pool, wat bewees dat het atoom negatieve deeltjes had, die werden genoemd elektronen.
Elektronen draaien miljarden keren per miljoenste van een seconde rond de kern, waardoor het atoom wordt gevormd en het zich gedraagt alsof het vast is.
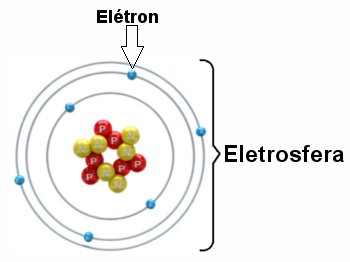
Illustratie van een elektrosfeer met drie elektronische lagen en elektronen die rond de kern draaien.
In het kort kunnen we een tabel maken om de drie belangrijkste subatomaire deeltjes te onderscheiden die deel uitmaken van de structuur van het atoom:

Massa en elektrische lading van de drie belangrijkste subatomaire deeltjes - protonen, neutronen en elektronen
De atomen van alle chemische elementen zijn samengesteld uit deze drie subatomaire deeltjes. Wat het ene chemisch element van het andere verschilt, is de hoeveelheid waarin deze deeltjes verschijnen, vooral de hoeveelheid protonen in de kern, die het atoomnummer wordt genoemd. Blijf erover studeren via de tekst. Chemish element.
* Mindmap door mij Diogo Lopes
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Chemie
Classificatie van materie, water, blauwzuurgas, kooldioxide, ammoniak, waterstof, helium, stoffen enkelvoudige, samengestelde stoffen, mengsels, fasen van een mengsel, homogeen mengsel, mengsel heterogeen.



