Een zuivere stof wordt gevormd door een enkel type chemische soort, dat wil zeggen dat de samenstelling en eigenschappen ervan vastliggen. Een mix bevat meer dan één type component, dus de organisatie ervan varieert.
We kunnen dus alleen een zuivere stof van een mengsel onderscheiden als we de samenstelling ervan kennen.
Bij het vergelijken van een glas water en een glas opgeloste suiker merken onze ogen geen verschil. Als we echter de inhoud van de twee glazen innemen, zullen we merken dat de ene de pure stof is en de andere uit een mengsel bestaat.
pure substanties
Een zuivere stof is de verzameling van slechts één chemische soort, dat wil zeggen, het is niet vermengd met andere.
Laten we water als voorbeeld nemen. Het water (H2O) staat bekend om zijn kenmerken en de specifieke eigenschappen van dit materiaal helpen ons om het te identificeren. de belangrijkste water eigenschappen zij zijn:
| Dichtheid | 1,00 g/cm3 |
|---|---|
| Fusiepunt | 0°C |
| Kookpunt | 100°C |
Wanneer een materiaal in zijn geheel vaste en onveranderlijke eigenschappen heeft, zeggen we dat het een pure substantie.
Wanneer we tafelzout, natriumchloride (NaCl), in een glas water doen en roeren, zal er een verandering optreden.

Het resultaat is een product met een tussenliggende dichtheid tussen die van water en zout. Dit komt omdat water niet langer een zuivere stof is en een Mengen.
Wanneer je dit mengsel probeert in te vriezen, zul je merken dat de smelttemperatuur lager zal zijn dan 0 °C en dat ook dit mengsel kookt niet bij 100 °C, er is meer warmte nodig om dit te verdampen Product.
Zuivere enkelvoudige en samengestelde stoffen
Zuivere stoffen worden als eenvoudig geclassificeerd als er in hun samenstelling atomen van slechts één chemisch element zijn.
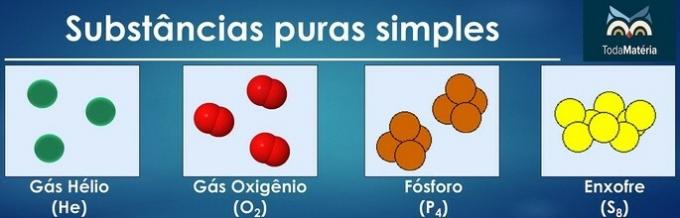
De rangschikking van atomen van twee of meer chemische elementen vormen pure samengestelde stoffen.

mengsels
Een mengsel komt overeen met het samenvoegen van twee of meer zuivere stoffen, die componenten worden genoemd.
In tegenstelling tot pure stoffen, zijn de eigenschappen ervan niet vast omdat ze afhankelijk zijn van het aandeel componenten in het mengsel.
Zie hoe dichtheid, een fysieke eigenschap, varieert met de hoeveelheid zout gemengd met water.
| Percentage zout in totale massa van het mengsel |
Mengseldichtheid (g/cm3) bij 20 °C |
|---|---|
| 1 | 1,005 |
| 8 | 1,056 |
| 12 | 1,086 |
| 16 | 1,116 |
| 26 | 1,197 |
Bron: FURNISS, B. S. et al. Vogel's leerboek praktische organische chemie. 4. red. Londen: Longman, 1987. P. 1.312.
Daarom heeft de toevoeging van water en zout, in welke verhouding dan ook, een variabele dichtheid en daarom kunnen we het mengsel niet classificeren als water of zout.
Homogene en heterogene mengsels
Homogene mengsels zijn mengsels die de componenten in slechts één fase presenteren en daarom op alle punten dezelfde eigenschappen hebben.

Wanneer we visueel meer dan één fase waarnemen, wordt het mengsel geclassificeerd als heterogeen.

Samenvatting over zuivere stoffen en mengsels
| Zuivere stoffen en mengsels | |
|---|---|
|
homogeen systeem (slechts één fase) |
pure substantie (een onderdeel) |
|
homogeen mengsel (meer dan één onderdeel in dezelfde fase) | |
|
heterogeen systeem (meer dan één fase) |
pure substantie (een component in verschillende fysieke toestanden) |
|
heterogeen mengsel (meer dan één component in meer dan één fase) |
Bekijk deze teksten voor meer informatie:
- Atomen
- Chemische elementen
- Scheiding van mengsels
Oefeningen met feedback met commentaar
1. (UFMG) Van een monster van een zuivere stof X zijn enkele eigenschappen bepaald. Alle alternatieven hebben eigenschappen die nuttig zijn om deze stof te identificeren, behalve:
a) dichtheid.
b) monstermassa.
c) oplosbaarheid in water.
d) kooktemperatuur.
e) smelttemperatuur.
Verkeerd alternatief: b) monstermassa.
a) JUIST. Dichtheid is de hoeveelheid materie in een bepaald volume. Als materiaalspecifieke eigenschap is het nuttig om een stof te identificeren.
b) FOUT. Massa is de hoeveelheid materie in een lichaam. Aangezien deze eigenschap van toepassing is op elke materie, ongeacht de samenstelling, is het niet mogelijk om deze te gebruiken om een stof te identificeren.
c) JUIST. Oplosbaarheid is het vermogen van een stof om al dan niet op te lossen in een bepaalde vloeistof. Als materiaalspecifieke eigenschap is het nuttig om een stof te identificeren.
d) JUIST. De kooktemperatuur komt overeen met de temperatuur van de overgang van vloeibare naar gasvormige toestand. Als materiaalspecifieke eigenschap is het nuttig om een stof te identificeren.
e) JUIST. Smelttemperatuur komt overeen met de temperatuur van verandering van vloeibare naar vaste toestand. Als materiaalspecifieke eigenschap is het nuttig om een stof te identificeren.
2. (Vunesp) Het etiket van een fles mineraalwater is hieronder weergegeven.
| Waarschijnlijke chemische samenstelling: |
|---|
| Calciumsulfaat 0,0038 mg/L |
| Calciumbicarbonaat 0,0167 mg/L |
Op basis van deze informatie kunnen we mineraalwater indelen als:
a) zuivere stof.
b) eenvoudige stof.
c) heterogeen mengsel.
d) homogeen mengsel.
e) colloïdale suspensie.
Correct alternatief: d) homogeen mengsel.
een fout. Water zou puur zijn als de samenstelling alleen H-moleculen had2O.
b) FOUT. Een eenvoudige stof bestaat uit atomen van slechts één chemisch element. Zuiver water is ook geen eenvoudige stof, omdat het wordt gevormd door waterstof- en zuurstofatomen (H2O) het is geclassificeerd als composiet.
c) FOUT. Een heterogeen mengsel heeft meer dan één fase, in welk geval we alleen water kunnen waarnemen.
d) JUIST. Omdat het maar één fase heeft, is het systeem homogeen. Als we naar de waterfles kijken, kunnen we alleen de vloeistof zien, omdat de calciumsulfaat- en calciumbicarbonaatverbindingen oplosbaar zijn in water en daarom worden opgelost.
e) FOUT. Een colloïdale suspensie is een heterogeen mengsel waarvan de componenten met behulp van een microscoop worden onderscheiden.
3. (UCDB) In een chemielaboratorium werden de volgende mengsels bereid:
IK. water/benzine
II. water/zout
III. water/zand
IV. benzine/zout
V. benzine/zand
Welke van deze mengsels zijn homogeen?
a) Geen.
b) Alleen II.
c) II en III.
d) I en II.
e) II en IV.
Correct alternatief: b) Alleen II.
een fout. Water is een anorganische verbinding en benzine een organische verbinding. Deze stoffen kunnen geen interactie aangaan en omdat ze verschillende dichtheden hebben, vormen ze een heterogeen mengsel.
b) JUIST. Het zout, natriumchloride, lost op in water en vormt een oplossing, wat een homogeen mengsel is.
c) FOUT. Zand, siliciumdioxide, vormt een heterogeen mengsel met water.
d) FOUT. Zout is een anorganische verbinding en benzine een organische verbinding. Deze stoffen kunnen geen interactie aangaan en omdat ze verschillende dichtheden hebben, vormen ze een heterogeen mengsel.
e) FOUT. Zand is een anorganische verbinding en benzine een organische verbinding. Deze stoffen kunnen geen interactie aan en vormen daarom een heterogeen mengsel.
4. (Ufes) In een goed gemengd systeem bestaande uit zand, zout, suiker, water en benzine is het aantal fasen:
a) 2.
b) 3.
c) 4.
d) 5.
e) 6.
Correct alternatief: b) 3.
FASE 1: Zout en suiker kunnen een interactie aangaan met water en door intermoleculaire krachten binden de moleculen zich en vormen een oplossing, die een homogeen mengsel is.
FASE 2: Water is een anorganische verbinding en benzine een organische verbinding. Deze stoffen kunnen geen interactie aangaan en omdat ze verschillende dichtheden hebben, vormen ze een heterogeen mengsel.
FASE 3: Zand is een silicaat dat geen chemische affiniteit heeft met water en benzine en daarom een fase vertegenwoordigt.
5. (Mackenzie) Het mengsel gevormd door:
a) ijsblokjes en waterige suikeroplossing (glucose).
b) N gassen2 en co2.
c) water en aceton.
d) water en kruisbessensiroop.
e) kerosine en dieselolie.
Correct alternatief: a) ijsblokjes en waterige suikeroplossing (glucose).
a) JUIST. Het is mogelijk om twee fasen waar te nemen: ijsblokjes en de glucose-oplossing, dus ze zijn een heterogeen systeem.
b) FOUT. Gassen zijn altijd een homogeen mengsel.
c) FOUT. Waterstofbindingen vormen zich tussen de carbonyl van propanon en het watermolecuul. Omdat het polaire stoffen zijn, kan aceton oplossen in water en een homogeen mengsel vormen.
d) FOUT. Deze twee componenten vermengen zich tot een homogeen systeem, omdat we alleen een rode vloeistof van de kruisbessensiroop zullen zien, omdat een verdunning optreedt door toevoeging van water.
e) FOUT. Beide zijn organische verbindingen en door chemische affiniteit vormen ze een enkele fase, wat neerkomt op een homogeen systeem.
Test je kennis met de oefeningen:
- Oefeningen over homogene en heterogene mengsels
- Oefeningen over het scheiden van mengsels
- Oefeningen over eigenschappen van materie