Koolwaterstoffen zijn verbindingen die alleen worden gevormd door koolstof en waterstof, met een algemene formule: CXHja.
Het is een grote hoeveelheid stoffen, waarvan de bekendste bestanddelen zijn van olie en aardgas.
De ruggengraat van een koolwaterstof bestaat uit koolstof en op zijn beurt binden de waterstofatomen zich via een covalente binding.
Ze worden veel gebruikt in de chemische industrie en zijn essentieel bij de productie van aardoliederivaten: brandstoffen, polymeren, paraffines, enz.
Eigenschappen van koolwaterstoffen
| moleculaire interactie | Het zijn praktisch niet-polaire verbindingen en hun moleculen zijn verbonden door een geïnduceerde dipool. |
|---|---|
| Smelt- en kookpunt | Ze zijn laag in vergelijking met polaire verbindingen. |
| aggregatie staten |
|
| Dichtheid | Ze hebben een lagere dichtheid dan water. |
| oplosbaarheid | Ze zijn onoplosbaar in water en oplosbaar in niet-polaire stoffen. |
| Reactiviteit |
|
Classificatie van koolwaterstoffen
Wat betreft de vorm van de belangrijkste koolstofketen, worden koolwaterstoffen ingedeeld in:
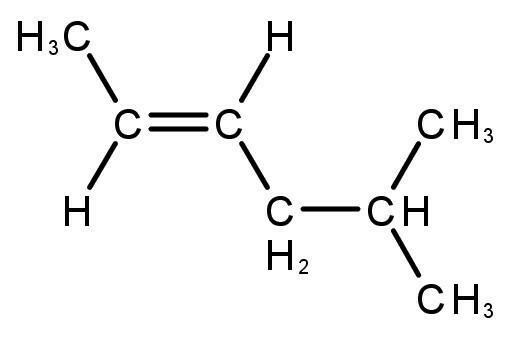
alifatische koolwaterstoffen
Gevormd door open of acyclische koolstofketens, die eindkoolstofatomen hebben.
- alkanen
- alkenen
- Alkynen
- Alkadiënen
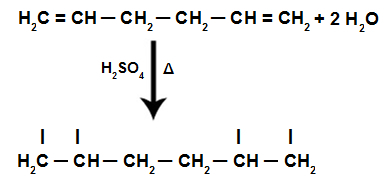
Voorbeeld:
Zie ook: koolstofketens
cyclische koolwaterstoffen
Gevormd door gesloten of cyclische koolstofketens die geen eindkoolstof bevatten.
- Cyclanen
- Cycli
- fietsers
- Aromaten
Voorbeelden:
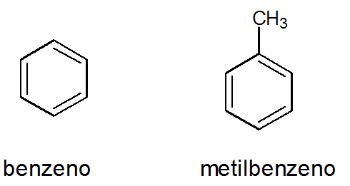
Zie ook: benzeen
Wat betreft de bindingen van koolstofketens, of ze nu enkel, dubbel of drievoudig zijn:
Verzadigde koolwaterstoffen
Verbindingen worden gevormd door enkele bindingen tussen koolstof- en waterstofatomen.
- alkanen
- Cyclanen
Voorbeeld:
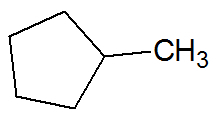
onverzadigde koolwaterstoffen
De gevormde verbindingen hebben dubbele of driedubbele bindingen tussen koolstof- en waterstofatomen.
- alkenen
- Alkynen
- Alkadiënen
- Cycli
- fietsers
- Aromaten
Lees ook over:
- Chemische bindingen
- Organische chemie
- Organische functies
Nomenclatuur
De nomenclatuur van koolwaterstoffen wordt gedefinieerd door de volgende termen:
| VOORVOEGSEL | INTERMEDIAIR | ACHTERVOEGSEL |
|---|---|---|
| Geeft het aantal koolstoffen in de keten aan. | Type link gevonden in string. | Identificatie van de functionele groep. |
| VOORVOEGSEL | INTERMEDIAIR | ACHTERVOEGSEL | ||
|---|---|---|---|---|
| 1C | LEERDE KENNEN | Alleen enkele link | EEN | O |
| 2C | ET | |||
| 3C | PROP | een dubbele binding | NL | |
| 4C | MAAR | |||
| 5C | PENT | twee dubbele bindingen | DIEN | |
| 6C | HEX | |||
| 7C | HEPT | een drievoudige link | IN |
|
| 8C | OKTOBER | |||
| 9C | NIET | Twee drievoudige links | DIN | |
| 10C | DEC |
Voorbeelden
Volg hoe koolwaterstofnamen worden gevormd:
| ethaan |
- Voorvoegsel: ET, wat overeenkomt met 2 koolstofatomen.
- Tussenpersoon: EEN, wat overeenkomt met enkele links.
- Achtervoegsel: O, wat overeenkomt met de koolwaterstoffunctie.
Kijk naar de andere voorbeelden:
| Propaan | |
| Etheen | |
| Etino | |
| propadieen |
In sommige gevallen is het nodig om de positie van de dubbele of driedubbele binding aan te geven. Nummering moet beginnen vanaf het dichtstbijzijnde einde van die link.
| 1,3-butadieen | |
| 1-butyn |
Meer informatie op:
- Butaan
- methaan
Soorten koolwaterstoffen
Bekijk de belangrijkste soorten koolwaterstoffen, hun kenmerken en de gebruikte verbindingen:
alkanen
Het zijn koolwaterstoffen met een open keten met enkelvoudige bindingen tussen koolstof- en waterstofatomen, waarvan de algemene formule is: ÇNeeH2n+2.
Alkanen Kenmerken:
- Ze worden ook wel paraffines of paraffines genoemd.
- Ze komen in de natuur voor in aardgas en olie.
- Worden gebruikt als brandstof: kookgas, benzine, dieselolie, enz.
Voorbeelden van alkanen

alkenen
Het zijn koolwaterstoffen met een open keten en hebben een dubbele binding, waarvan de algemene formule is: ÇNeeH2n.
Alkenen kenmerken
- Ze worden ook wel olefinen, alkenen of ethenische koolwaterstoffen genoemd.
- Ze worden industrieel verkregen door het kraken van alkanen die in aardolie aanwezig zijn.
- Ze worden gebruikt als grondstof in de industrie: kunststoffen, kleurstoffen, explosieven, enz.
Voorbeelden van alkenen

Alkynen
Het zijn koolwaterstoffen met een open keten met de aanwezigheid van een dubbele binding, waarvan de algemene formule is: ÇNeeH2n-2.
Alkynen kenmerken
- Ze zijn reactiever dan alkanen en alkenen vanwege de drievoudige binding.
- Alkynen met meer dan 14 koolstofatomen zijn vast.
- De meest gebruikte alkyn is acetyleen, dat veel wordt gebruikt bij de productie van synthetische rubbers, textielvezels en kunststoffen.
Voorbeelden van alkynen

Alkadiënen
Het zijn koolwaterstoffen met een open keten en de aanwezigheid van twee dubbele bindingen, waarvan de algemene formule is: ÇNeeH2n-2
Kenmerken van alkadiënen
- Ook wel dienen of dialkenen genoemd
- Ze komen in de natuur voor in terpenen, die worden gewonnen uit essentiële fruitoliën.
- De bekendste verbinding is isopreen, dat voorkomt in natuurlijk rubber en essentiële oliën.
Voorbeelden van alkadiënen

Cyclanen
Het zijn koolwaterstoffen met een gesloten keten met enkelvoudige bindingen tussen koolstof- en waterstofatomen, waarvan de algemene formule is: ÇNeeH2n.
Cyclaankenmerken
- Ze worden ook wel cycloalkanen of cycloparaffinen genoemd.
- Ze zijn onstabiel onder hoge druk.
- Ketens met meer dan 6 koolstofatomen zijn stabiel, terwijl ketens met minder dan 5 koolstofatomen reactief zijn.
Voorbeelden van cyclanen

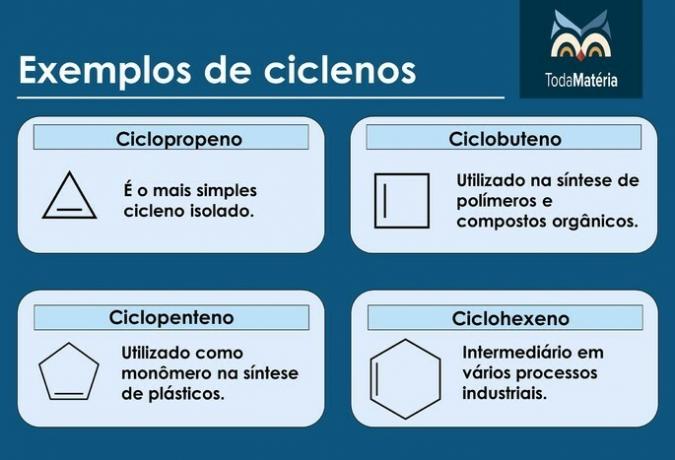
Cycli
Het zijn koolwaterstoffen met een gesloten keten met de aanwezigheid van een dubbele binding, waarvan de structuurformule is: ÇNeeH2n-2.
Kenmerken van cycli
- Ze worden ook wel cycloalkenen genoemd.
- Verbindingen van 3 tot 5 koolstofatomen zijn onstabiel.
- Ze zijn meestal te vinden in aardgas, olie en aardolie.
Voorbeelden van cycli
fietsers
Het zijn koolwaterstoffen met een gesloten keten met de aanwezigheid van een drievoudige binding, waarvan de structuurformule is: ÇNeeH2n-4.
Fietskenmerken
- Ze worden ook wel cycloalkynen of cycloalkynen genoemd.
- Het zijn cyclische en onverzadigde koolwaterstoffen.
- Ze zijn onstabiel door drievoudige binding en komen niet voor in de natuur.
Voorbeelden van cyclines

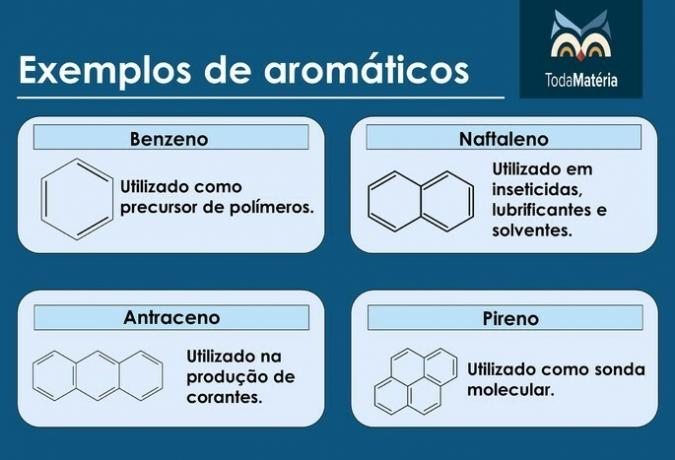
Aromaten
Het zijn koolwaterstoffen met een gesloten keten met afwisselend enkele en dubbele bindingen.
Kenmerken van aromaten
- Ze worden ook arena's genoemd.
- Het zijn onverzadigde verbindingen, omdat ze 3 dubbele bindingen hebben.
- Ze bestaan uit ten minste één aromatische ring.
Voorbeelden van aromaten
- Aardolie
- olieraffinage
- Acetyleen
Koolwaterstof samenvatting
| Bezetting | Algemene formule |
Kenmerken |
|---|---|---|
| alkaan | Open ketting met eenvoudige schakels. |
|
| alkeen | Open ketting met dubbele binding. | |
| alkyn | Open ketting met driedubbele binding. | |
| alkadieen | Open ketting met twee dubbele bindingen. | |
| Cyclanen | Gesloten ketting met eenvoudige verbindingen. | |
| Cycli | Gesloten ketting met dubbele binding. | |
| fietsers | Gesloten ketting met drievoudige schakel. | |
| Aromatisch | Variabele | Gesloten keten met afwisselend enkele en dubbele bindingen. |
Oefeningen over koolwaterstoffen
1. (UEMA) LPG (Liquefied Petroleum Gas), ook in de volksmond bekend als kookgas, is een brandstof niet-hernieuwbaar fossiel dat 's nachts op kan raken als het niet wordt gebruikt met planning en zonder overmaat. Het is onder andere samengesteld uit propaan C3H8, butaan C4H10 en kleine hoeveelheden propyleen C3H6 en buteen C4H8. Deze organische verbindingen worden geclassificeerd als koolwaterstoffen die overeenkomsten en verschillen tussen hen hebben. Op basis van het type binding tussen koolstoffen en de classificatie van de koolstofketen van de bovenstaande verbindingen kan worden gesteld dat:
a) de onverzadigde verbindingen zijn propaan en butaan.
b) de onverzadigde verbindingen zijn propeen en buteen.
c) de onverzadigde verbindingen zijn propeen en butaan.
d) de verbindingen hebben homocyclische ketens.
e) de verbindingen hebben heterocyclische ketens.
Alternatief b) de onverzadigde verbindingen zijn propeen en buteen.
een fout. Deze verbindingen hebben geen onverzadigingen, hun bindingen zijn eenvoudig.
b) JUIST. De term "en" geeft de aanwezigheid van dubbele bindingen in de verbindingen aan.

c) FOUT. Butaan heeft geen onverzadigingen.

d) FOUT. Deze ketens zijn gesloten en de koolstofatomen zijn verbonden door enkelvoudige bindingen.
e) FOUT. Deze ketens hebben een heteroatoom, zoals zuurstof en stikstof.

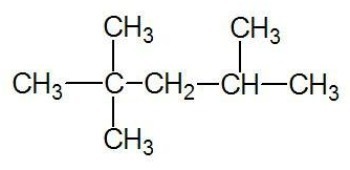
2. (Uel) Een van de koolwaterstoffen met formule C5H12 kan koolstofketen hebben:
a) verzadigd cyclisch.
b) heterogeen acyclisch.
c) vertakt cyclisch.
d) onverzadigd open.
e) open vertakt.
Alternatief e) open vertakt.
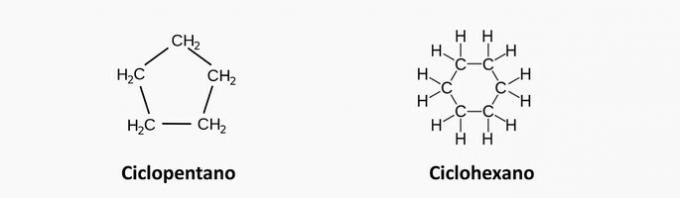
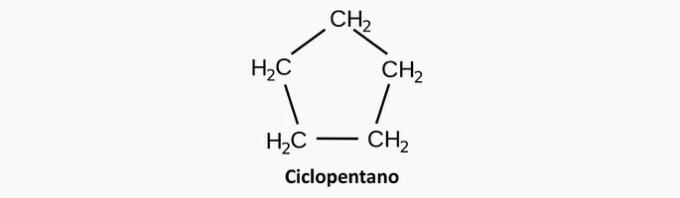
een fout. Een verzadigde cyclische verbinding komt overeen met een cyclaan, waarvan de formule C. isNeeH2n.
Voorbeeld:
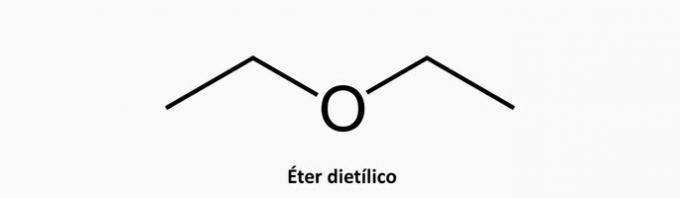
b) FOUT. Een heterogene acyclische verbinding heeft de aanwezigheid van een ander element naast de geïntercaleerde koolstof in de keten.
Voorbeeld:
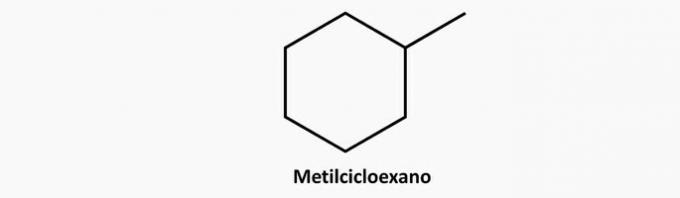
c) FOUT. Een vertakte cyclische verbinding heeft formule CNeeH2n.
Voorbeeld:
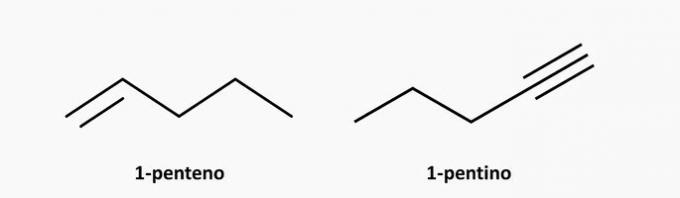
d) FOUT. Een onverzadigde verbinding met open keten kan een alkeen of een alkyn zijn, waarvan de formule respectievelijk C is.NeeH2n en CNeeH2n-2.
Voorbeelden:
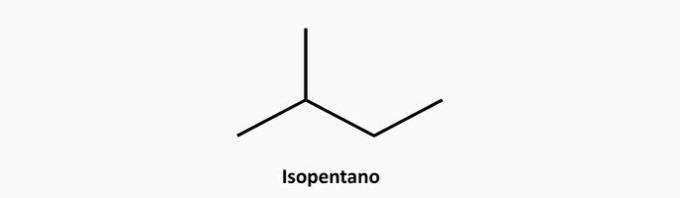
e) JUIST. Een vertakte verbinding met open keten is een alkaan waarvan de formule C. isNeeH2n+2. Een verbinding van 5 koolstofatomen en 12 waterstofatomen zou isopentaan kunnen zijn.
Voorbeeld:
3. (PUC) Alkynen zijn koolwaterstoffen:
a) verzadigde alifatische verbindingen.
b) verzadigde alicyclische verbindingen.
c) onverzadigde alifatische verbindingen met dubbele binding.
d) onverzadigde alicyclische verbindingen met drievoudige binding.
e) drievoudig gebonden onverzadigde alifatische verbindingen.
Alternatief e) onverzadigde alifatische verbindingen met drievoudige binding.
een fout. De open-keten en enkelvoudig gebonden verbindingen zijn alkanen.
Voorbeeld:

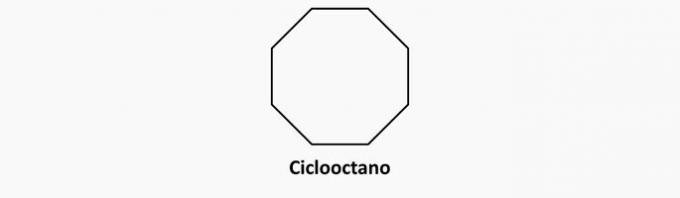
b) FOUT. Cyclische verbindingen met enkele bindingen zijn cyclanen.
Voorbeeld:
c) FOUT. Open-keten en dubbel-gebonden verbindingen zijn alkenen.
Voorbeeld:
d) FOUT. Cyclische en drievoudig gebonden verbindingen zijn cyclinen.
Voorbeeld:
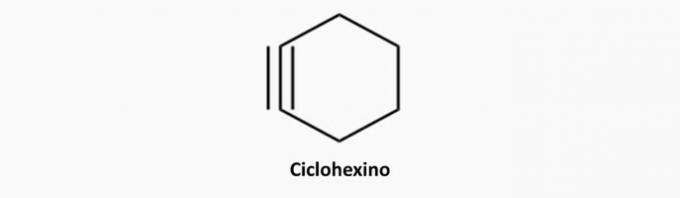
e) JUIST. Alkynen zijn verbindingen met een open keten en drievoudig gebonden.

Wil je je kennis blijven testen? Bekijk dan zeker deze lijsten:
- Oefeningen over koolwaterstoffen
- Oefeningen over organische chemie
- Oefeningen over organische functies