Voordat we het concept van molaire massa en aantal mol, laten we eens kijken naar enkele belangrijke definities in deze context:
→ Kiesterm
Kies komt van het woord molecuul, maar wat is precies een molecuul? Het is de verzameling atomen die verbonden zijn door chemische bindingen.
→ Molecuulmassa (MM)
Het is mogelijk om de massa van een molecuul te berekenen door de som van de atoommassa's van elk atoom waaruit het betreffende molecuul bestaat. Het resultaat wordt Moleculaire Massa (MM) genoemd.
Wat zou de molecuulmassa zijn van waterstofsulfide (H2S) bijvoorbeeld?
Eerst moet je weten wat de atoom massa van elk atoom, dat wordt gegeven door het periodiek systeem van elementen.
Atoommassa waterstof (H) = 1 a.m.u. (eenheid per atoommassa)
Atoommassa van zwavel (S) = 32,1 a.u.u.
Molecuulmassa is de som van de atoommassa's van atomen.
Opmerking: de waterstof van het H-molecuul2S heeft een coëfficiënt van 2, dus je moet de massa met 2 vermenigvuldigen. Berekenen:
Molecuulmassa van H2S = 1 • 2 + 32,1 = 34,1 u
(H) + (S) = (H)2S)
Molaire massa en het aantal mol
Niet stoppen nu... Er is meer na de reclame ;)
De molaire massa, evenals het aantal mol, is gerelateerd aan de Constante van Avogadro (6,02 x 1023) via het volgende concept:
''Het aantal elementaire entiteiten in 1 mol komt overeen met de constante van Avogadro, waarvan de waarde 6,02 x 10 is.23 mol-1.''
Daarom is de molaire massa de massa van 6,02 x 1023 chemische entiteiten en wordt uitgedrukt in g/mol.
Mindmap - Mol
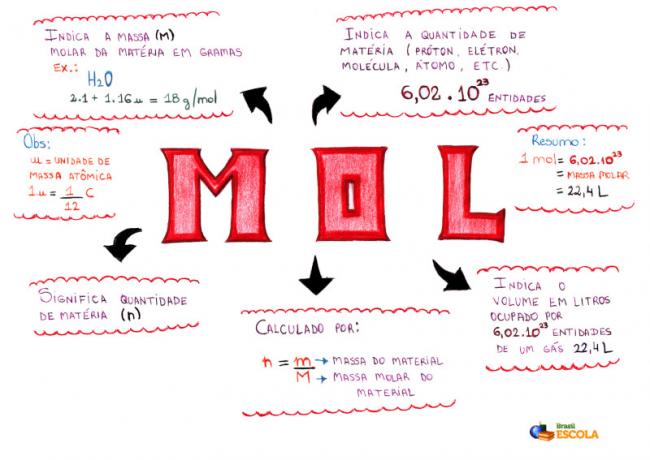
* Om de mindmap te downloaden, Klik hier!
Voorbeeld: H2zo
Moleculaire massa = 34,1 u
Molaire massa (M) = 34,1 g/mol
Dit betekent dat we bij 34,1 g/mol waterstofsulfide 6,02 x 10. hebben23 moleculen of 1 mol waterstofsulfidemoleculen.
Conclusie
Molecuulmassa en molmassa hebben dezelfde waarden, wat verschilt is de meeteenheid. De molaire massa is gerelateerd aan het aantal mol dat wordt gegeven door de constante van Avogadro.
* Mindmap door mij Diogo Lopes
Door Liria Alves
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
SOUZA, Liria Alves de. "Molmassa en molaantal"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/massa-molar-numero-mol.htm. Betreden op 27 juni 2021.

