Ir zinātnes nozare, kas pēta ķīmisko reakciju ātrumu un faktorus, kas to ietekmē, to sauc par ķīmisko kinētiku. Ķīmiskās reakcijas var definēt kā tādu parādību kopumu, kurās divas vai vairākas vielas reaģē savā starpā, radot dažādus savienojumus. Ķīmiskais vienādojums ir grafisks ķīmiskās reakcijas attēlojums, kur reaģenti parādās pirmajā locījumā, bet produkti - otrajā.
A + B  C + D
C + D
Reaģentu produkti
Zināšanas un reakciju izpēte ir ne tikai rūpnieciski ļoti svarīga, bet arī saistīta ar mūsu ikdienas dzīvi.
Reakcijas ātrums ir tas, cik ātri reaģenti tiek patērēti vai cik ātri veidojas produkti. Sveces dedzināšana un rūsas veidošanās ir lēnas reakcijas piemēri. Dinamītā nitroglicerīna sadalīšanās ir ātra reakcija.
Ķīmisko reakciju ātrumu nosaka ar empīriskiem likumiem, kurus sauc par ātrums, ko izsaka no reaģentu un produktu koncentrācijas ietekmes uz ātrumu reakcija.
Ķīmiskās reakcijas notiek ar dažādu ātrumu, un tās var mainīt, jo papildus reaģentu un produktu koncentrācija, reakcijas ātrums ir atkarīgs arī no citiem faktoriem piemēram:
Reaģenta koncentrācija: jo lielāka reaģentu koncentrācija, jo ātrāk notiks reakcija. Lai notiktu reakcija starp divām vai vairākām vielām, ir nepieciešams, lai molekulas sadurtos, lai saites pārtrūktu un sekojoši veidotos jaunas. Sadursmju skaits būs atkarīgs no A un B koncentrācijas. Skatīt attēlu:
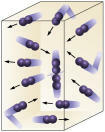
Molekulas saduras biežāk, ja
mēs palielinām reaģējošo molekulu skaitu.
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Ir viegli redzēt, ka augstākas koncentrācijas dēļ palielināsies sadursmes starp molekulām.
kontakta virsma: kontakta virsmas palielināšanās palielina reakcijas ātrumu. Piemērs ir gadījums, kad mēs izšķīdinām sasmalcinātu sonrisa tableti, un tā izšķīst ātrāk nekā tad, ja tas būtu vesels, tas notiek tāpēc, ka mēs palielinām kontakta virsmu, kas reaģē ar Ūdens.
Spiediens: palielinot gāzveida sistēmas spiedienu, palielinās reakcijas ātrums.
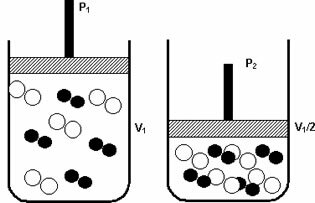
Spiediena palielināšanās no P1 līdz P 2 samazināja tilpumu no V1 līdz V1 / 2, paātrinot reakciju molekulu pieejas dēļ.
Iepriekš redzamais skaitlis parāda, ka, samazinoties tilpumam otrajā traukā, palielināsies arī tilpums spiediens, kas pastiprina molekulu sadursmes un kā rezultātā palielina reakcija.
Temperatūra: paaugstinot sistēmas temperatūru, palielinās arī reakcijas ātrums. Temperatūras paaugstināšana nozīmē molekulu kinētiskās enerģijas palielināšanu. Ikdienā mēs varam novērot šo faktoru, gatavojot ēdienu, un mēs palielinām plīts liesmu tā, lai ēdiens ātrāk sasniegtu gatavošanas pakāpi.
Katalizatori: Katalizatori ir vielas, kas paātrina mehānismu, neatstājot pastāvīgas izmaiņas, tas ir, reakcijas laikā tie netiek patērēti. Katalizatori ļauj reakcijai iet alternatīvu ceļu, kas prasa mazāk aktivācijas enerģijas, izraisot reakcijas ātrāku norisi. Ir svarīgi atcerēties, ka katalizators paātrina reakciju, bet nepalielina ražu, tas ir, tas ražo tādu pašu produkta daudzumu, bet īsākā laika posmā.
Autore Líria Alves
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
SOUZA, Líria Alves de. "Ķīmiskā kinētika"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm. Piekļuve 2021. gada 27. jūnijam.