Šķīdība ir vielu fizikālā īpašība, lai izšķīdinātu vai neizšķīdinātu noteiktā šķidrumā.
tiek saukts izšķīdis, ķīmiskie savienojumi, kas izšķīst citā vielā. O šķīdinātājs tā ir viela, kurā izšķīdušā viela tiks izšķīdināta, veidojot jaunu produktu.
ķīmiskā šķīdināšana ir izšķīdušās vielas dispersijas process šķīdinātājā, iegūstot homogēnu šķīdumu vai maisījumu.
Izšķīdušās vielas var iedalīt:
- Šķīstošs: ir izšķīdušās vielas, kas izšķīst šķīdinātājā.
- Nedaudz šķīstošs: ir izšķīdušās vielas, kuras ir grūti izšķīdināt šķīdinātājā.
- Nešķīstošs: ir izšķīdušās vielas, kas nešķīst šķīdinātājā.
Šķīdības izplatīts princips ir šāds: "patīk izšķīst kā”. Tas nozīmē, ka polārā izšķīdušā viela mēdz izšķīst polārā šķīdinātājā. Tas pats attiecas uz nepolārām vielām.
Skatiet dažus piemērus:
- Ogļūdeņraži, savienojumi, kas atrodas benzīnā, ir nepolāri, un tiem ir maz šķīdības ūdenī, kas ir polāri.
- Spirti, piemēram, etanols un metanols, ir polāri, ņemot vērā skābekļa klātbūtni oglekļa ķēdē, un tāpēc tie šķīst ūdenī.
- Sāļiem ir atšķirīga šķīdība. Tos var klasificēt: šķīstošais sāls un praktiski nešķīstošais sāls.
Šķīdības koeficients
O šķīdības koeficients (Cs) nosaka izšķīdušās vielas maksimālo ietilpību, kas izšķīst noteiktā šķīdinātāja daudzumā. Tas, atkarībā no temperatūras apstākļiem.
Kopumā šķīdības koeficients ir izšķīdušās vielas daudzums, kas nepieciešams, lai piesātinātu standarta šķīdinātāja daudzumu noteiktā stāvoklī.
Piemēram, apsveriet šādu situāciju:
Sākotnēji glāzē sālsūdens (NaCl) sāls pazūd ūdenī.
Tomēr, ja pievieno vairāk sāls, kādā brīdī tas sāks uzkrāties glāzes apakšā.
Tas ir tāpēc, ka ūdens, kas ir šķīdinātājs, ir sasniedzis šķīdības robežu un maksimālo koncentrācijas daudzumu. To sauc arī piesātinājuma punkts.
Šķīdumu, kas paliek trauka apakšpusē un nešķīst, sauc par dibena ķermeni vai nogulsnēm.
Saistībā ar piesātinājuma punkts, risinājumi tiek klasificēti trīs veidos:
- nepiesātināts šķīdums: kad izšķīdušās vielas daudzums ir mazāks par Cs.
- piesātināts šķīdums: kad izšķīdušās vielas daudzums ir tieši tāds pats kā Cs. Tas ir piesātinājuma ierobežojums.
- pārsātināts šķīdums: kad izšķīdušās vielas daudzums ir lielāks par Cs.
Šķīdības produkts
Kā mēs redzējām, šķīdība norāda šķīdumā izšķīdušās izšķīdušās vielas daudzumu. O šķīdības produkts (Kps) ir līdzsvara konstante, kas tieši saistīta ar šķīdību.
Tās aprēķins ļauj noteikt, vai šķīdums ir piesātināts, nepiesātināts vai piesātināts ar nogulsnēm. Šis aprēķins ir saistīts ar šķīdināšanas līdzsvaru un jonu koncentrāciju šķīdumā.
Tas ir tāpēc, ka šķīdības produkts attiecas uz jonu vielu izšķīdināšanas līdzsvaru.
saprast vairāk par Šķīdinātājs un šķīdinātājs.
Šķīdības līkne
Temperatūras izmaiņām pakļautās vielas ķīmiskā šķīdības spēja nav lineāra. Šķīdības spējas svārstības atkarībā no temperatūras ir pazīstamas kā šķīdības līkne.
Lielākajai daļai cieto vielu šķīdības koeficients palielinās, paaugstinoties temperatūrai. Tādējādi katra materiāla šķīdība notiek proporcionāli, atkarībā no temperatūras.
Katrai vielai ir sava šķīdības līkne konkrētam šķīdinātājam.
Šķīdības svārstības tiek uzskatītas par lineārām, ja tās nav temperatūras ietekmē. Lai zinātu variāciju, nepieciešams aplūkot šķīdības līkni.
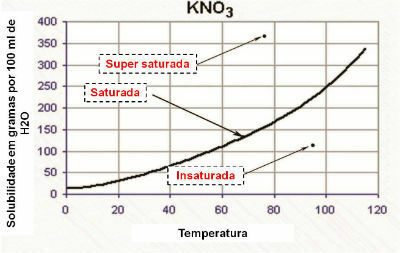
Šķīdības līkne
Grafikā šķīdības līkne parāda, ka risinājums ir:
- piesātināts: kad punkts atrodas šķīdības līknē.
- nepiesātināts: kad punkts atrodas zem šķīdības līknes.
- viendabīgi piesātināts: kad punkts atrodas virs šķīdības līknes.
Lasiet arī par Risinājuma koncentrācija.
Šķīdības koeficienta formula
Formula šķīdības koeficienta aprēķināšanai ir:
Cs = 100. m1/ m2
Kur:
Cs: šķīdības koeficients
m1: izšķīdušās vielas masa
m2: šķīdinātāja masa
Vai vēlaties uzzināt vairāk? lasīt Ķīmiskie risinājumi un Šķīdumu atšķaidīšana.
Vingrinājumi
1. (Fuvest-SP) Ķīmiķis savā laboratorijas rokasgrāmatā aprakstītajā procedūrā nolasa šo instrukciju:
"5,0 g hlorīda izšķīdina 100 ml ūdens istabas temperatūrā ...".
Kuras no zemāk minētajām vielām ir minētas tekstā?
a) Cl2.
b) CCl4.
c) NaClO.
d) NH4Cl.
e) AgCl.
d) NH4Cl.
2. (UFRGS-RS) Noteiktam sāls šķīdība ūdenī 25 ° C temperatūrā ir vienāda ar 135 g / l. Pilnīgi izšķīdinot 150 g šī sāls vienā litrā ūdens 40 ° C temperatūrā un lēnām atdzesējot sistēmu līdz 25 ° C, iegūst viendabīgu sistēmu, kuras šķīdums būs:
a) atšķaidīts.
b) koncentrēts.
c) nepiesātināti.
d) piesātināts.
e) pārsātināts.
e) pārsātināts.
3. (Mackenzie-SP) Tipisks pārsātināta šķīduma piemērs ir:
Minerālūdens.
b) mājās gatavots serums.
c) soda slēgtā traukā.
d) spirts 46 ° GL.
e) etiķis.
c) soda slēgtā traukā.
4. (PUC-RJ) Ņemiet vērā zemāk redzamo skaitli, kas attēlo 3 neorganisko sāļu šķīdību gramos uz 100 g H2O noteiktā temperatūras diapazonā:
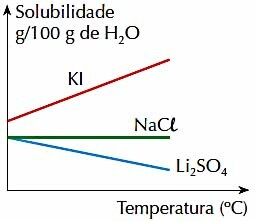
Pārbaudiet pareizo paziņojumu:
a) 3 sāļu šķīdība palielinās līdz ar temperatūru.
b) Temperatūras paaugstināšanās veicina Li šķīdināšanu2TIKAI4.
c) KI šķīdība norādītajā temperatūras diapazonā ir lielāka nekā citu sāļu šķīdība.
d) NaCl šķīdība mainās atkarībā no temperatūras.
e) 2 sāļu šķīdība samazinās līdz ar temperatūru.
c) KI šķīdība norādītajā temperatūras diapazonā ir lielāka nekā citu sāļu šķīdība.


