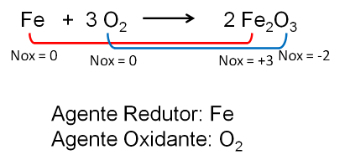
Vidurinių mokyklų studentai visada susiduria redokso reakcijos su jonai, tiek stojamųjų egzaminų, tiek nacionalinio vidurinės mokyklos egzamino (Enem) metu. Taigi šių lygčių subalansavimas gali būti labai bijotas dalykas.
Siekiant palengvinti šios temos supratimą, šiuo tekstu siekiama atkreipti dėmesį į redokso lygčių su jonais balansavimas su tam tikrų veiksmų aprašymu. Tam mes turime pradėti nuo šio tipo cheminės reakcijos nustatymo.
At redoksinės reakcijos su jonais yra identifikuojami pagal vieną ar daugiau komponentų, turinčių krūvį (teigiamą ar neigiamą), tai yra jonai (katijonai ar anijonai), kurių gali būti reagentuose ar produktuose, kaip yra abiejuose pavyzdžiuose a sekite:
1-as pavyzdys:Kr2O72- + Fe2+ + H+ → Kr3+ + Fe3+ + H2O
2-as pavyzdys:Cl2 + C + H2O → CO2 + H+ + Cl-
Norėdami atlikti subalansuoti redoksinių reakcijų su jonais lygtis, būtina atlikti kelis veiksmus, tokius kaip:
1-as žingsnis: nustatyti NOX kiekvieno reagento atomo ir lygties produktų atomo;
2-as žingsnis: patikrinkite, kuri rūšis nukentėjo oksidacija;
3-as žingsnis: nustatykite NOX rūšis, kuri buvo oksiduota;
4 žingsnis: padauginkite trečiame etape rastą kitimą iš oksiduojančių rūšių atomų skaičiaus;
5-as žingsnis: patikrinkite, kuri rūšis nukentėjo sumažinimas;
6-asis žingsnis: nustatykite rūšių, kurioms sumažėjo, NOX kitimą;
7-as žingsnis: padauginkite trečiajame etape rastą kitimą iš rūšies atomų skaičiaus, kurį jis sumažina;
8-as žingsnis: naudokite ketvirtame etape nustatytą vertę kaip rūšies, kuri mažina, koeficientą;
9-as žingsnis: kaip oksiduojančių rūšių koeficientą naudokite septintame etape nustatytą vertę;
10-as žingsnis: įtraukite koeficientus į kitas rūšis pagal metodą bandomojo balansavimo. Toms rūšims, kur tai neįmanoma, kaip koeficientus nurodykite nežinomuosius;
11-as žingsnis: padauginkite kiekvienos rūšies koeficientą iš jos apkrovos;
12-as žingsnis: sulyginkite reagentų ir produktų krūvių sumą, kad rastumėte vienos iš nežinomų rūšių koeficientą;
13-as žingsnis: atlikite balansą naudodami bandymo metodą.
Siekdami palengvinti supratimą, atlikite aukščiau aprašytą žingsnį po žingsnio toliau pateiktame a pavyzdyje redokso lygtis su jonais:

Joninė lygtis, rodanti kai kuriuos jonus ir bendras 0 krūvio grupes
1-as žingsnis: Kiekvieno atomo NOX.

Lygtyje esančių atomų NOX
2 žingsnis: Rūšys, kurios oksiduojasi.

Rūšys, kurios lygtyje patiria oksidaciją
Kadangi jodo NOX nuo reagento iki produkto padidėja nuo -1 iki 0, oksiduojasi būtent ta rūšis.
3 žingsnis: Nustatykite oksiduotų rūšių NOX kitimą.
Nesustokite dabar... Po reklamos yra daugiau;)
Norėdami tai padaryti, tiesiog atimkite didžiausią NOX iš mažiausio:
∆NOX = (0) – (-1)
∆ NOX = 0 + 1
∆ NOX = 1
4 žingsnis: NOX padauginimas iš kiekio.
Šiame žingsnyje dauginame trečiame etape rastą variaciją iš rūšies atomų skaičiaus.
Aš- = ∆NOX.1
Aš- = 1.1
Aš- = 1
5-as žingsnis: Rūšys, kurioms taikoma redukcija.

Rūšys, kurioms sumažėja lygtis
Kadangi chromo NOX kiekis nuo reagento iki produkto sumažėja nuo +7 iki +3, redukcija vyksta būtent toje rūšyje.
6-as žingsnis: Nustatykite redukuotų rūšių NOX kitimą.
Norėdami tai padaryti, tiesiog atimkite didžiausią NOX iš mažiausio:
∆NOX = (+6) – (+3)
∆ NOX = +6 – 3
∆ NOX = 3
7-as žingsnis: NOX padauginimas iš kiekio.
Šiame žingsnyje dauginame šeštajame etape nustatytą variaciją iš rūšies atomų skaičiaus.
Kr2O72- = ∆NOX.1
Kr2O72- = 3.2
Kr2O72- = 6
8-as žingsnis: Pradėkite balansuoti.
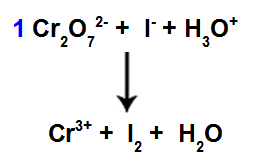
Balansavimo pradžia naudojant rastą koeficientą
Šiame etape mes pradedame pusiausvyrą pateikdami koeficientą, nustatytą ketvirtame etape rūšims, kurios patyrė sumažėjimą.
9-as žingsnis: Tęskite balansavimą.

Balansavimo tęsimas naudojant rastą koeficientą
10-as žingsnis: Naudokite bandymo metodą.
Reagente yra 6 I atomai, todėl koeficientą 3 turime įtraukti į I rūšį2 produkto, nes jame yra tik 2 Cl atomai;
Kaip ir 1 rūšyje, Cr2O72-, yra 2 Cr atomai, mes turėtume įvesti koeficientą 2 į Cr rūšis3+ produkto.
Kadangi deguonies turime trijose rūšyse, o dviejose iš jų nėra koeficientų, kad galėtume tęsti pusiausvyrą, turime nurodyti nežinomas likusias rūšis:
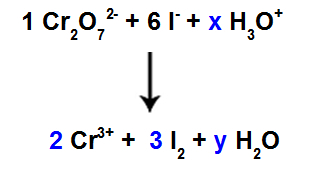
Koeficientai, naudojant bandymo metodą
11-as žingsnis: Kiekvienos rūšies padauginimas iš jos apkrovos.
Norėdami tai padaryti, tiesiog padauginkite rūšies koeficientą iš jo apkrovos taip:
Reagentuose:
Kr2O72- = 1.(-2) = -2
Aš- = 6.(-1) = -6
H3O+ = x. (+ 1) = + x
Produktai:
Kr3+ = 2.(+3) = +6
Aš2 = 4.0 = 0
H2O = y.0 = 0
12-as žingsnis: Kainų suma.
Atlikdami šį veiksmą, turime pridėti reagentų ir produktų kiekį, rastą 11 veiksme:
Reagentai = produktai
-2 + (-8) + (+ x) = +6 + 0 + 0
-2 - 6 + x = 6
-8 + x = 6
x = 6 + 8
x = 14
13-as žingsnis: Balansavimo pabaiga.
Norėdami užbaigti balansavimą, turime:
Į 12 rūšį gautą rezultatą įrašykite į H rūšį3O+;
Kadangi reagente dabar yra 42 H atomai, reikia įvesti koeficientą 21 į H rūšį2Produkte esantis.
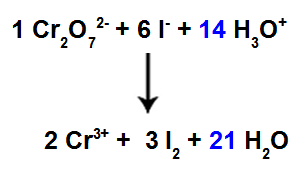
Subalansuota jonų reakcijos lygtis
Mano. Diogo Lopes Dias
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
DIENOS, Diogo Lopes. „Raudonosios redukcijos reakcijos su jonais“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-com-ions.htm. Žiūrėta 2021 m. Birželio 28 d.