Redokso reakcijos apima elektronų perdavimą tarp atomų, jonų ar molekulių.
Vykstant oksidacijos-redukcijos reakcijai, įvyksta oksidacijos skaičiaus (Nr.) Pokyčiai. Oksidaciją sudaro oksidacijos ir redukcijos procesai:
- Oksidacija: rezultatai elektronų nuostoliai ir padidėjo nosis.
- Redukcija: rezultatai elektronų padidėjimas ir sumažėjo nosies.
Kai vienas elementas atsisakys elektronų, kitas juos priims. Taigi bendras gautų elektronų skaičius yra lygus bendram prarastų elektronų skaičiui.
Redoksinių reakcijų į degimą, koroziją ir fotosintezę pavyzdžiai.
Pavyzdžiai
Priklausomai nuo elemento, kuris gauna ar dovanoja elektronus, mes turime šiuos pavadinimus:
- Redukuojantis agentas: Tas, kuris patiria oksidaciją, sukelia redukciją ir padidina jo skaičių. Tai ir praranda elektronus.
- Oksiduojantis agentas: Tas, kuris patiria redukciją, sukelia oksidaciją ir sumažina savo NOx skaičių. Tai ir gauna elektronus.
O oksidacijos skaičius reiškia elemento elektrinį krūvį tuo metu, kai jis dalyvauja a cheminis ryšys.
Ši sąlyga yra susijusi su elektronegatyvumas, kuri yra kai kurių elementų polinkis priimti elektronus.
1. Stebėkite pirmąjį pavyzdį, atkreipkite dėmesį, kad reakcijoje tarp geležies ir chloro pasikeičia oksidacijos skaičius. O chloras nes jis yra labiau elektronegatyvus, jis gauna elektronus:
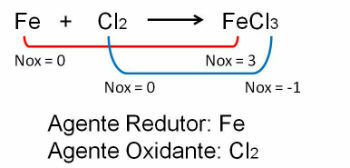
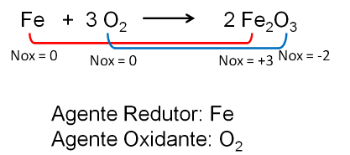
2. Reakcija tarp geležies ir deguonies. Deguonis yra labiau elektronegatyvus, todėl gauna elektronus ir sumažina jų oksidacijos skaičių.
Sužinokite daugiau, taip pat skaitykite:
- Oksidacija
- Degimas
- Cheminės reakcijos
- elektronai
Mankšta išspręsta
1. (PUC-RS) Dėl oksidacijos lygties - nesubalansuota redukcija Fe0 + CuSO4 → Fe2(TIK4)3 + Cu0, galima sakyti, kad:
a) vario oksidacijos skaičius vario sulfate yra +1.
b) geležies atomas praranda 2 elektronus.
c) varis oksiduojasi.
d) geležis yra oksidatorius.
e) geležis oksiduojasi.
Rezoliucija:
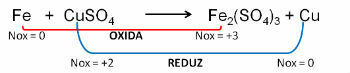
Atsakyti:
e) geležis oksiduojasi.
Pratimai
1. (UFAC-AC) Pagal šią cheminę lygtį: Zn + 2 HCℓ → ZnCℓ2 + H2
a) elementas Zn oksiduojasi ir reaguoja kaip oksiduojantis agentas.
b) Zn elementas oksiduojasi ir reaguoja kaip reduktorius.
c) Zn elementas redukuoja ir reaguoja kaip reduktorius.
d) HCℓ yra reduktorius.
e) lygtis klasifikuojama kaip grįžtama.
b) Zn elementas oksiduojasi ir reaguoja kaip reduktorius.
2. (ITA-SP) Joninėje reakcijoje Ni (s) + Cu2+(aq) → Ni2+(aq) + Cu (s)
a) nikelis yra oksidatorius, nes jis yra oksiduojamas.
b) nikelis yra reduktorius, nes yra oksiduotas.
c) vario jonas yra oksidatorius, nes jis yra oksiduojamas.
d) vario jonas yra reduktorius, nes jis yra redukuotas.
e) tai nėra redoksinė reakcija, todėl nėra oksidatoriaus ar reduktoriaus.
b) nikelis yra reduktorius, nes yra oksiduotas.
3. (UFRGS) Buitinių baliklių veiklioji medžiaga yra hipochlorito jonas ClO-. Balinimo procesuose šis jonas redukuojamas; Tai reiškia, kad:
a) medžiaga, kuri veikia hipochloritą, gauna elektronus.
b) jo struktūroje sumažėja elektronų skaičius.
c) ClO yra reduktorius.
d) ClO- virsta elementiniu chloro arba chlorido jonu.
e) nevyksta elektronų perdavimas.
d) ClO- virsta elementiniu chloro arba chlorido jonu.