Heso dėsnis leidžia apskaičiuoti entalpijos kitimą, ty energijos kiekį, esantį medžiagose po cheminių reakcijų. Taip yra todėl, kad neįmanoma išmatuoti pačios entalpijos, bet jos kitimo.
Hesso dėsnis yra termochemijos tyrimo pagrindas.
Šį įstatymą eksperimentiškai sukūrė Germain Henry Hess, kuris nustatė:
Entalpijos pokytis (ΔH) vykstant cheminei reakcijai priklauso tik nuo pradinės ir galutinės reakcijos būsenų, neatsižvelgiant į reakcijų skaičių.
Kaip galima apskaičiuoti Heso dėsnį?
Entalpijos pokytį galima apskaičiuoti atėmus pradinę entalpiją (prieš reakciją) iš galutinės entalpijos (po reakcijos):
ΔH = Hf - Hi
Kitas būdas jį apskaičiuoti yra entalpijų suma kiekvienoje iš tarpinių reakcijų. Nepriklausomai nuo reakcijų skaičiaus ir tipo.
ΔH = ΔH1 + ΔH2
Kadangi atliekant šį skaičiavimą atsižvelgiama tik į pradinę ir galutinę vertes, daroma išvada, kad tarpinė energija neturi įtakos jos kitimo rezultatui.
Tai yra konkretus atvejis Energijos taupymo principas, a Pirmasis termodinamikos dėsnis.
Jūs taip pat turėtumėte žinoti, kad Heso dėsnį galima apskaičiuoti kaip matematinę lygtį. Norėdami tai padaryti, galite atlikti šiuos veiksmus:
- Apverskite cheminę reakciją, tokiu atveju ΔH ženklas taip pat turi būti pakeistas;
- Padauginkite lygtį, taip pat reikia padauginti ΔH vertę;
- Padalinkite lygtį, taip pat reikia padalyti ir ΔH vertę.
žinoti daugiau apie entalpija.
Entalpijos schema
Heso dėsnį taip pat galima vizualizuoti naudojant energijos diagramas:
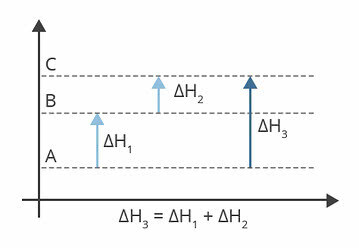
Aukščiau pateiktoje diagramoje parodyti entalpijos lygiai. Šiuo atveju patiriamos reakcijos yra endoterminės, tai yra, absorbuojama energija.
ΔH1 yra entalpijos pokytis, įvykstantis nuo A iki B. Tarkime, kad tai 122 kj.
ΔH2 yra entalpijos pokytis, įvykstantis nuo B iki C. Tarkime, kad tai 224 kj.
ΔH3 yra entalpijos pokytis, įvykstantis nuo A iki C.
Taigi mums svarbu žinoti ΔH vertę3, nes tai atitinka reakcijos entalpijos pokytį nuo A iki C.
Mes galime rasti ΔH reikšmę3, iš kiekvienos reakcijos entalpijos sumos:
ΔH3 = ΔH1 + ΔH2
ΔH3 = 122 kj + 224 kj
ΔH3 = 346 kj
Arba ΔH = Hf - Hi
ΔH = 346 kj - 122 kj
ΔH = 224 kj
Stojimo egzaminas: išspręstas žingsnis po žingsnio
1. (Fuvest-SP) Remiantis entalpijos variantais, susijusiais su šiomis reakcijomis:
N2 g) + 2 O2 g) → 2 NE2 g) ∆H1 = +67,6 kJ
N2 g) + 2 O2 g) → N2O4 g) ∆H2 = +9,6 kJ
Galima numatyti, kad entalpijos kitimas susijęs su NO dimerizacijos reakcija2 bus lygus:
2 NO2 (g) → 1 N2O4 g)
a) -58,0 kJ b) +58,0 kJ c) -77,2 kJ d) +77,2 kJ e) +648 kJ
Rezoliucija:
1 žingsnis: Apverskite pirmąją lygtį. Taip yra todėl, kad NE2 g) pagal pasaulinę lygtį jis turi pereiti į reaguojančiųjų pusę. Atminkite, kad, pakeisdamas reakciją, ∆H1 taip pat pakeičia ženklą, pakeisdamas jį į neigiamą.
Antroji lygtis yra išsaugota.
2 NE2 g) → N2 g) + 2 O2 g) ∆H1 = - 67,6 kJ
N2 g) + 2 O2 g) → N2O4 g) ∆H2 = +9,6 kJ
2 žingsnis: atkreipkite dėmesį, kad N2 g) atsiranda produktuose ir reagentuose, ir tas pats atsitinka su 2 mol O2 (g).
2 NE2 g) → N2 g)+ 2 O2 g)∆H1 = - 67,6 kJ
N2 g) + 2 O2 g) → N2O4 g) ∆H2 = +9,6 kJ
Taigi juos galima atšaukti ir gauti tokią lygtį:
2 NE2 g) → N2O4 g).
3 žingsnis: Matote, kad priėjome prie visuotinės lygties. Dabar turime pridėti lygtis.
∆H = ∆H1 + ∆H2
∆H = - 67,6 kJ + 9,6 kJ
∆H = -58 kJ ⇒ A alternatyva
Iš neigiamos ∆H vertės mes taip pat žinome, kad tai yra egzoterminė reakcija, išskiriant šilumą.
Sužinokite daugiau, taip pat skaitykite:
- termochemija
- Termochemijos pratimai
- Endoterminės ir egzoterminės reakcijos
- Antrasis termodinamikos dėsnis
Pratimai
1. (UDESC-2012) Metano dujos gali būti naudojamos kaip kuras, kaip parodyta 1 lygtyje:
CH4 g) + 2O2 g) → CO2 g) + 2H2Og)
Naudodamiesi žemiau pateiktomis, jūsų manymu, reikalingomis termocheminėmis lygtimis ir Hesso dėsnio sąvokomis, gaukite 1 lygties entalpijos vertę.
Çs + H2Og) → COg) + H2 g) ΔH = 131,3 kJ mol-1
COg) + ½2 g) → CO2 g) ΔH = - 283,0 kJ mol-1
H2 g) + ½2 g) → H2Og) ΔH = - 241,8 kJ mol-1
Çs + 2H2 g) → CH4 g) ΔH = - 74,8 kJ mol-1
1 lygties entalpijos vertė, išreikšta kJ, yra:
a) - 704,6
b) - 725,4
c) - 802,3
d) - 524,8
e) - 110,5
c) - 802,3
2. (UNEMAT-2009) Hesso dėsnis turi esminę reikšmę tiriant termochemiją ir gali būti tvirtinamas kaip „entalpijos kitimas cheminėje reakcijoje priklauso tik nuo pradinės ir galutinės būsenos reakcija". Viena iš Hesso dėsnio pasekmių yra ta, kad termochemines lygtis galima apdoroti algebriniu būdu.
Atsižvelgiant į lygtis:
Ç (grafitas) + O2 g) → CO2 g) ΔH1 = -393,3 kj
Ç (Deimantas) + O2 g) → CO2 g) ΔH2 = -395,2 kj
Remdamiesi aukščiau pateikta informacija, apskaičiuokite grafito anglies entalpijos pokytį deimanto anglimi ir pažymėkite teisingą alternatyvą.
a) -788,5 kj
b) +1,9 kj
c) +788,5 kj
d) -1,9 kj
e) +98,1 kj
b) +1,9 kj