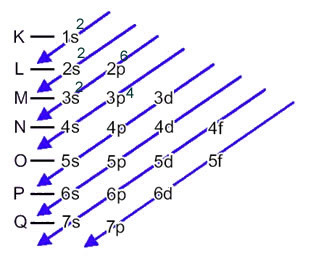
ატომის ელექტრონების ელექტრონული განაწილება ნეიტრალურ ან ფუნდამენტურ მდგომარეობაში ჩვეულებრივ ხორციელდება პაულინგის დიაგრამა, ნაჩვენებია ქვემოთ:
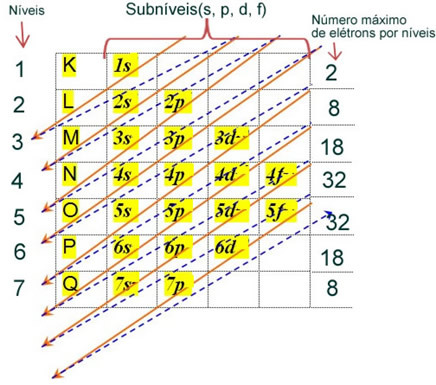
ამ განაწილების დეტალური წესების ნახვა შეგიძლიათ შემდეგ ვებ – გვერდზე შემდეგ ორ ტექსტში:ელექტრონების ელექტრონული განაწილება"და"ელექტრონული განაწილების წესები”.
იონების ელექტრონული განაწილება თავდაპირველად მუშაობს ისევე, როგორც ნეიტრალურ მდგომარეობაში მყოფი ატომებისთვის; მხოლოდ ერთი განსხვავებით. ვინაიდან იონი არის ატომი, რომელმაც მოიპოვა ან დაკარგა ელექტრონები, ეს უნდა გავითვალისწინოთ და გავაკეთოთ შემდეგი:

მნიშვნელოვანი დაკვირვებაა: ცვლილება ხორციელდება ყველაზე დაბალ დაქვემდებარებულ დონეზე და არა ყველაზე ენერგიულ.
თუ იონი არის ა კატიონი, ჩვენ უნდა ამოიღეთ ელექტრონები რომ მან დაკარგა. მოდით ვნახოთ მაგალითი:
რკინის ატომს (ატომური რიცხვი = 26) აქვს შემდეგი ელექტრონული განაწილება ქვესერვებში ენერგიული თანმიმდევრობით: 1 ს2 2-იანები2 2 გვ6 3 ს2 3 გვ6 4-იანები2 3D6. რაც შეეხება ელექტრონულ ფენებს, გვაქვს: K =2; L = 8; M = 14; N = 2
ეს განაწილება ნაჩვენებია პაულინგის დიაგრამაზე:
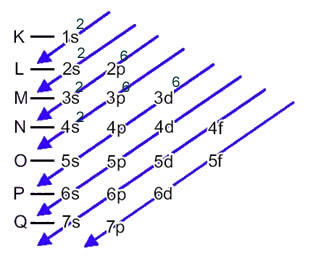
როდესაც რკინის ატომი კარგავს 2 ელექტრონს, ის იქცევა Fe კატიონში.2+. ამრიგად, თქვენი ელექტრონული განაწილებისას ჩვენ მოგვიწევს ამოიღეთ 2 ელექტრონი ბოლო გარსიდან(N) და არა ყველაზე ენერგიული ქვესკნელიდან, როგორც ქვემოთაა ნაჩვენები:
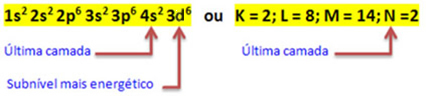
ამრიგად, Fe kation- ის ელექტრონული განაწილება2+ მოცემულია:
1 ს2 2-იანები2 2 გვ6 3 ს2 3 გვ6 3D6 ან K = 2; L = 8; M = 14
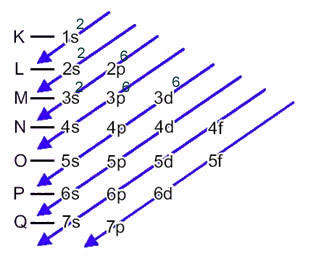
ახლა, თუ ჩვენ უნდა შევასრულოთ ელექტრონული განაწილება ანიონი, ჩვენ უნდა დაამატეთ მიღებული ელექტრონები.იხილეთ თუ როგორ ხდება ეს შემდეგ მაგალითში:
გოგირდის ანიონი (16ს2-) წარმოიქმნება გოგირდის ატომიდან (16S) 2 ელექტრონის მოგებით, როგორც მითითებულია მუხტით 2-. მისი ელექტრონული განაწილება მოცემულია შემდეგნაირად:
1 ს2 2-იანები2 2 გვ6 3 ს2 3 გვ4 ან K = 2; L = 8; M = 6
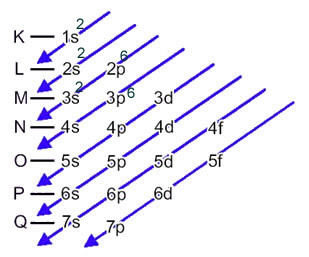
ამ შემთხვევაში, ბოლო ქვესკნელი იგივეა, რაც ენერგეტიკული ქვედენა, 3p. ასე რომ, მას დავამატებთ გოგირდის ანიონის ორ ელექტრონს:
1 ს2 2-იანები2 2 გვ6 3 ს2 3 გვ6 ან K = 2; L = 8; M = 8
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/distribuicao-eletronica-ions.htm

