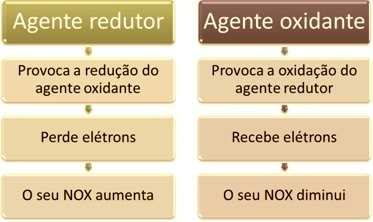
ერთ-ერთი მთავარი მახასიათებელი, რომელიც განასხვავებს ჟანგვა-შემცირების რეაქციას (ან რედოქსირება) დანარჩენი არის ჟანგვითი და შემამცირებელი აგენტის არსებობა, რომელიც შეიძლება განისაზღვროს შემდეგნაირად:
მაგალითად, გადახედეთ ქიმიურ რეაქციას ქვემოთ, სადაც ალუმინის (Al) კოროზიირდება წყალხსნარში მარილმჟავას (HCl) ხსნარში. ალუმინის ატომები ელექტრონებს გადასცემენ H კათიონებს+(აქ) და აწარმოოს ალ კატიონი3+(აქ):
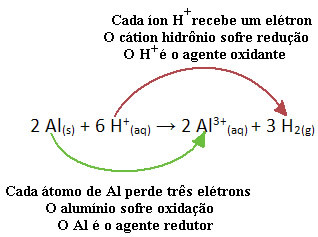
გაითვალისწინეთ, რომ რადგან ალ-მა ელექტრონებს გადასცა, ეს ნიშნავს რომ მან გამოიწვია შემცირება H კათიონებისა+(აქ); ამიტომ მას უწოდებენ შემცირების აგენტი. უკვე კათიონი ჰ+(აქ) ამოიღო ელექტრონები ალუმინისგან, იწვევს ჟანგვას იმ ლითონის; ამიტომ იგი მოქმედებს, როგორც ა ჟანგვის აგენტი.
ყოველდღიურ ცხოვრებაში არსებობს მრავალი დაჟანგვის და ამცირებელი აგენტის მუშაობის მრავალი მაგალითი. გადახედეთ ზოგიერთ მათგანს და გახსოვდეთ, რომ ყველა შემთხვევაში შემცირება ხდება დაჟანგვასთან ერთად; ამიტომ, თუ არსებობს შემამცირებელი საშუალება, ასევე არსებობს ჟანგვითი საშუალება.
- შემცირების აგენტების მაგალითები:
- ფოტოგრაფიულ ფილმებში: ფოტოგრაფიული ფილმები შეიცავს მსუბუქად მგრძნობიარე ვერცხლის მარილებს. იმ წერტილებში, სადაც სინათლის სიხშირეა, ხდება Ag იონების შემცირება+, რის შედეგადაც განსხვავდება უარყოფითი მხარეები.

- Ვიტამინი ცე: ვიტამინი C (L- ასკორბინის მჟავა) არის ძლიერი განმსაზღვრელი საშუალება წყალხსნარში. მას აქვს განსაკუთრებული საშუალება დაჟანგვისთვის და ამიტომ იგი ფართოდ გამოიყენება, განსაკუთრებით ისეთ საკვებში, როგორიცაა ა ანტიოქსიდანტი, ანუ ემატება სხვა საკვებს და იცავს მათ შესაძლო დაჟანგვისგან, საკუთარი გამო მსხვერპლი. ამის მაგალითია ისეთი ხილი, როგორიცაა ვაშლი და მსხალი, რომლებიც ბნელდება ჰაერში ჟანგბადთან კონტაქტში, რადგან ისინი იჟანგება. მაგრამ როდესაც ნაყოფს დაამატებთ მცირე რაოდენობის ფორთოხლის ან ლიმონის წვენს (რომელიც შეიცავს C ვიტამინს) დაჭრილი, ეს ხელს უშლის ამ რეაქციას, რადგან ვიტამინი C მოქმედებს როგორც შემამცირებელი საშუალება და იჟანგება ნაყოფამდე.

- წყალბადის გაზი: წყალბადის გაზი (H2) გამოიყენება სარაკეტო ძრავის დროს და ითვლება ენერგეტიკულ ერთ – ერთ მნიშვნელოვან ალტერნატივად, რადგან მისი წვის შედეგად გამოიყოფა დიდი რაოდენობით ენერგია და არ ხდება დამაბინძურებლები. ამ რეაქციის დროს, წყალბადის მოქმედებს როგორც შემამცირებელი საშუალება, ჟანგბადის დაჟანგვის შედეგად.
- ჟანგვითი აგენტების მაგალითები:
- ძმრის წარმოებაში: როდესაც ღვინო ექვემდებარება ჰაერს, ის იქცევა ძმარში, რომლის ძირითადი კომპონენტია ძმარმჟავა. ეს იმიტომ ხდება, რომ ღვინოში არსებული ეთილის სპირტი ან ეთანოლი იჟანგება ატმოსფერულ ჟანგბადთან შეხებისას, რის შედეგადაც ხდება ძმარმჟავა. ამრიგად, ჟანგბადი არის ჟანგვითი საშუალება. ტერმინ "დაჟანგვის" წარმოშობაც კი უკავშირდება ჟანგბადთან რეაქციას.

- ჟანგში: როგორც წინა მაგალითში იყო ნათქვამი, ჟანგბადი მოქმედებს როგორც ალკოჰოლის დაჟანგვის საშუალება. და ეს ასევე ხდება სხვადასხვა ლითონებთან, მაგალითად, რკინასთან შეხებისას, რაც იწვევს ჟანგის პროცესს. ჰაერში ჟანგბადის გარდა, ამ შემთხვევაში სხვა ჟანგვითი საშუალებებია წყალი ან მჟავე ხსნარი.
- გაუფერულებებში: მათეთრებლის გათეთრების ეფექტი განპირობებულია შემდეგი ორი შემამცირებელი საშუალების არსებობით: o ჰიპოქლორიტული ანიონი (ზოგადად ნატრიუმის მარილის სახით - NaOCl), მაგალითად, მათეთრებლად; და წყალბადის ზეჟანგი (H2ო2), გაყიდვაში, როგორც წყალბადის ზეჟანგი. ამ ორ ნაერთს აქვს ძალიან ძლიერი დაჟანგვის ტენდენცია და იწვევს სხვა ქიმიური სახეობების შემცირებას. ამიტომ, ისინი პასუხისმგებელნი არიან დაჟანგვის ნივთიერებებზე, რომლებიც მუქ ფერს ანიჭებენ პროდუქტებს. მაგალითად, ცელულოზაში, ლიგნინი იშლება და ხდება უფრო მსუბუქი და მგრძნობიარე. ლაქების მოცილებისა და ქსოვილის გაუფერულების შემთხვევაში, ეს დაჟანგვის საშუალებები იწვევს ორგანული მოლეკულების დაჟანგვას, როგორიცაა ცხიმები და საღებავები.

- სუნთქვის აპარატებში: უბრალო ერთჯერადი სუნთქვა შედგება სუფთა მილისგან, რომელიც შეიცავს კალიუმის და სილიციუმის დიქრომატული მარილის წყალხსნარს, გოგირდის მჟავით დატენიანებული; შერეული ნარინჯისფერ ფერს. ეს მარილი, ალკოჰოლის ორთქლთან კონტაქტში, რომელსაც შეიცავს მთვრალი მძღოლის სუნთქვა, რეაგირებს და იცვლის ფერს მწვანეს. ეს ნიშნავს, რომ გამოწვეულია ეთანოლის (ალკოჰოლის) დაჟანგვა ეთანალამდე.

ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm
