THE ენთალპია არის თერმოდინამიკური ფუნქცია, რომლითაც ითვლის იზობარულ პროცესებში ჩართულ სითბოსანუ მუდმივი წნეხის ქვეშ მყოფნი. მისი განვითარება მოხდა კალორიული თეორიის დაცემის შემდეგ მალევე, წინსვლასთან ერთად თერმოდინამიკა 1840-1850 წლებში.
ენთალპია, ამისთვის რაუმიკა, არ აქვს დიდი მნიშვნელობა, თუ იგი დამუშავებულია როგორც აბსოლუტური და იზოლირებული მნიშვნელობა, მაგრამ მას აქვს როდესაც განიხილება მისი მნიშვნელობის ცვალებადობა ქიმიურ პროცესში. პროცესის ენთალპიის ცვალებადობის გამოსათვლელად რამდენიმე გზა არსებობს, რომელთაგან მთავარია ფორმირების, შებოჭვის ენერგია და ასევე იქჰეი ჰესისგან.
წაიკითხეთ ასევე: რა არის გიბსის თავისუფალი ენერგია?
ენთალპიის რეზიუმე
ენთალპია არის თერმოდინამიკური ინსტრუმენტი მუდმივი წნევის დროს მიმდინარე პროცესებში ჩართული სითბოს გამოსათვლელად.
იგი განისაზღვრა ამერიკელმა ფიზიკოსმა ჯოშაჰ ვ. გიბსი, კალორიული თეორიის დაცემის კონტექსტში.
ქიმიაში ჩვენ ყოველთვის ვიყენებთ ენთალპიის ცვლილებას, რომელიც წარმოდგენილია როგორც ΔH.
ქიმიურ რეაქციებს, რომლებიც შთანთქავენ სითბოს, ეწოდება ენდოთერმული და აქვთ ΔH > 0.
ქიმიურ რეაქციებს, რომლებიც ათავისუფლებენ სითბოს, ეწოდება ეგზოთერმული და აქვს ΔH <0.
ვიდეო გაკვეთილი ენთალპიაზე
რა არის ენთალპია?
ენთალპია, რომელიც ყოველთვის წარმოდგენილია H-ით, თავდაპირველად იყო განსაზღვრული ამერიკელი ფიზიკოსის ჯოშა უილარდ გიბსის მიერ, რომელსაც მან უწოდა სითბოს მუდმივი წნევის ფუნქცია, რადგან, მისი სიტყვებით:
„[…] ფუნქციის დაქვეითება წარმოადგენს, ყველა შემთხვევაში, როდესაც წნევა არ იცვლება, სისტემის მიერ დათმულ სითბოს“.
გიბსის ნაშრომიდან ჩვენ შეგვიძლია გავიგოთ ენთალპია, როგორც თერმოდინამიკური ფუნქცია, რომლის ვარიაცია რიცხობრივად უდრის სისტემაში გაცვლილი სითბოს რაოდენობას წნევა მუდმივი. ეს ნიშნავს, რომ იზობარულ პროცესებში (როგორც ქიმიური პროცესების უმეტესობა), იცის გამოთვალეთ ენთალპიის ფუნქციის ცვალებადობა, შემდეგ შეგიძლიათ იცოდეთ სისტემას შორის გაცვლილი სითბოს მნიშვნელობა და სამეზობლო.

ასეთი კორელაცია სითბოს მიზეზებთან ბევრი სტუდენტი შეცდომით ფიქრობს, რომ ენთალპია სინონიმია სითბო ან რაღაც ენერგიის შემცველობა, სითბოს შემცველობა, გამოთავისუფლებული სითბო და შთანთქმული სითბო და ა.შ.
ენთალპია წარმოიშვა კალორიული თეორიის დაშლის კონტექსტში, რომელიც სითბოს განიხილავდა, როგორც შეუდარებელ მატერიალურ ნივთიერებას, რომელიც გადადიოდა თბილი სხეულებიდან ცივ სხეულებზე. ამრიგად, საჭირო იყო სითბოს გამოთვლის ახალი ხელსაწყო. მაშინ გამოსავალი იყო რაოდენობების გამოყენება, რომლებსაც უკვე ჰქონდათ განსაზღვრული თერმოდინამიკური განტოლებები, როგორიცაა ენთალპია.
წაიკითხეთ ასევე: როგორ გამოვთვალოთ ხსნარის ენთალპიის ცვლილება?
ენთალპიის ვარიაცია
ვინაიდან ენთალპია არის ინსტრუმენტი, რომელიც გამოიყენება ქიმიურ პროცესში გაცვლილი სითბოს გამოსათვლელად, აზრი არ აქვს მის გამოყენებას, როგორც აბსოლუტურ, იზოლირებულ რიცხვს, მაგრამ მისი ვარიაციის გათვალისწინებით, ანუ პრაქტიკაში, ჩვენ მხოლოდ უნდა შევაფასოთ, თუ რამდენად შეიცვალა ენთალპია ქიმიური პროცესის დროს, ვინაიდან თერმოდინამიკა გვარწმუნებს, რომ მისი ვარიაცია არის რიცხობრივად უდრის პროცესში გამოთავისუფლებულ ან შთანთქმულ სითბოს.
მკაცრად რომ ვთქვათ, ჩვენ შეგვიძლია განვსაზღვროთ ენთალპიის ვარიაცია, როგორც:
ΔH = Hფინალი - ჰსაწყისი
როგორც ქიმიურ პროცესებში, საბოლოო საფეხურად შეიძლება ჩაითვალოს პროდუქტები, ხოლო საწყისი ეტაპი შეიძლება ჩაითვალოს რეაგენტები. ასევე ხშირია ენთალპიის ვარიაციის განმარტება, როგორც:
ΔH = Hპროდუქტები - ჰრეაგენტები
პრაქტიკული და ინტერპრეტაციული თვალსაზრისით, თუ ენთალპიის ცვლილება დადებითია (ΔH> 0), ჩვენ ვამბობთ, რომ ქიმიური რეაქცია არის ენდოთერმულიანუ, მთელი პროცესის განმავლობაში ხდება სითბოს შთანთქმა. უკვე თუ ენთალპიის ცვლილება უარყოფითია (ΔH< 0), ჩვენ ვამბობთ, რომ ქიმიური რეაქცია არის ეგზოთერმული, ანუ სითბო გამოიყოფა მთელი პროცესის განმავლობაში.
ენთალპიის ცვალებადობა, ხშირ შემთხვევაში, შეინიშნება გრაფიკებში, როგორც ნაჩვენებია შემდეგ მაგალითებში.
მაგალითი 1:
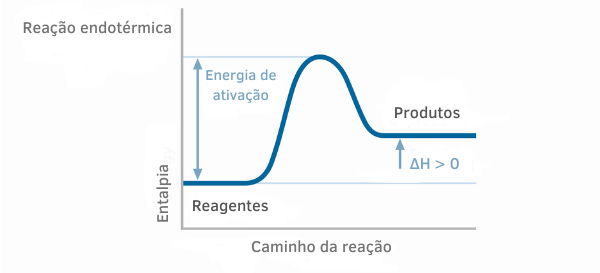
ენდოთერმული რეაქციის სქემა
ენდოთერმული რეაქციების ენთალპიის გრაფიკებში ჩანს, რომ პროდუქტების ენთალპიის რაოდენობა უფრო მეტია, ვიდრე რეაქტიული ნივთიერებების რაოდენობა, რაც მიუთითებს, რომ რეაქციის გასწვრივ ცვალებადობა დადებითია. ამრიგად, თუ ΔH > 0, შეგვიძლია ვთქვათ, რომ ქიმიური პროცესი მოხდა სითბოს შთანთქმით.
მაგალითი 2:
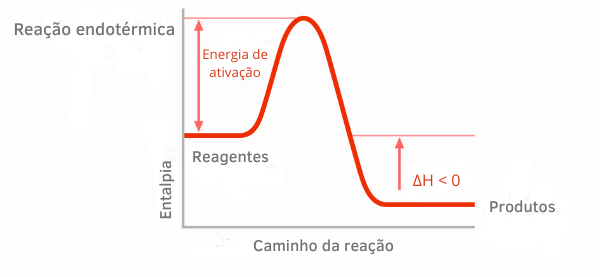
ეგზოთერმული რეაქციის სქემა:
ეგზოთერმული რეაქციების ენთალპიის გრაფიკებში ჩანს, რომ პროდუქტების ენთალპიის რაოდენობა უფრო მცირეა, ვიდრე რეაქტიული ნივთიერებების, რაც მიუთითებს იმაზე, რომ რეაქციის გასწვრივ ცვალებადობა უარყოფითია. ამრიგად, როგორც ΔH < 0, შეგვიძლია ვთქვათ, რომ ქიმიური პროცესი მოხდა სითბოს გათავისუფლებით.
წაიკითხეთ მეტი ქიმიური რეაქციების ამ კლასიფიკაციის შესახებ ტექსტში: FORენდოთერმული და ეგზოთერმული პროცესები.
ენთალპიის სახეები
ფორმირების ენთალპია
THE ფორმირების ენთალპია é გათვლილი დაფუძნებულია ქიმიური რეაქციების ფორმირება, ეს არის რეაქციები, რომლებშიც ნაერთი ნივთიერებების ერთი მოლი წარმოიქმნება მათი ყველაზე სტაბილური მარტივი ნივთიერებებისგან ოთახის ტემპერატურაზე და 1 ატმოსფერო წნევაზე.
ჰ2(გ) + ½ O2 (ზ) → H2O (l) H°ვ = -286 კჯ/მოლ
ფორმირების ენთალპიის დიდი უპირატესობა ის არის, რომ მარტივ ნივთიერებებს, რომლებიც უფრო სტაბილურია ოთახის ტემპერატურაზე და 1 ატმოსფეროზე წნევის დროს, აქვთ ენთალპია ნულამდე. ეს არ ნიშნავს, რომ ისინი რეალურად ნულოვანია, მაგრამ გამარტივებისა და უკეთესი კლასიფიკაციისთვის, მათ ასე განიხილავენ.
ყოფნა ჰ = ჰპროდუქტები - ჰრეაგენტები, თუ გავითვალისწინებთ, რომ ჰრეაგენტები = 0, შეგვიძლია ვთქვათ, რომ ΔH-ის დაკვირვებული მნიშვნელობა მხოლოდ იმ პროდუქტებთან არის დაკავშირებული, რომლებიც, ამ შემთხვევაში, ყოველთვის არის ნაერთი ნივთიერების ერთი მოლი. მაშასადამე, ჩვენ ჩამოვთვლით ამ მნიშვნელობას, როგორც წყლის წარმოქმნის სტანდარტული ენთალპიის ვარიაციით, წარმოდგენილი ΔH°-ითვ.
ამ მეთოდოლოგიით რამდენიმე ნივთიერებას ჰქონდა თავისი ვარიაციები სტანდარტული ენთალპია ფორმირების ცხრილები, როგორც ქვემოთ ვხედავთ.
ნივთიერება |
ფორმირების ენთალპია (ΔH°ვ) კჯ/მოლში |
CO2 (გ) |
-393,4 |
CaO(s) |
-634,9 |
HI(g) |
+25,9 |
არა (გ) |
+90,1 |
სავალდებულო ენთალპია
შემაკავშირებელი ენთალპია ემსახურება ენერგიის რაოდენობის მითითებას, რომელიც მონაწილეობს მოცემული მოლის გახეთქვაში ან წარმოქმნაში. ქიმიური ბმა.
გასაგებია, რომ, ქიმიური კავშირის გასატეხად საჭიროა სითბოს შთანთქმაისე, რომ შემაკავშირებელმა ატომებმა გაზარდოს მათი შინაგანი ენერგია და, შესაბამისად, გაზარდეთ თქვენი კინეტიკური ენერგია. უფრო დიდით კინეტიკური ენერგიაატომები უფრო ინტენსიურად ვიბრირებენ, რაც იწვევს ბმების გაწყვეტას. ამრიგად, კავშირის ყოველი გაწყვეტა ენდოთერმული პროცესია.
წინააღმდეგ შემთხვევაში, ქიმიური ბმის შესაქმნელად, ატომები კარგავენ მოძრაობის თავისუფლებას და საჭიროებენ მოძრაობის ხარისხის შემცირებას, მათი კინეტიკური ენერგიის შემცირებას. სათადარიგო ენერგია შემდეგ გამოიყოფა სითბოს სახით. ამრიგად, ყველა ბმის ფორმირება ეგზოთერმული პროცესია.
ქვემოთ მოყვანილი ცხრილი გვიჩვენებს ენერგიების მნიშვნელობებს, რომლებიც დაკავშირებულია თითოეულ ქიმიურ კავშირთან.
კავშირი |
შებოჭვის ენერგია (კჯ/მოლი) |
C-H |
412,9 |
C-C |
347,8 |
O═O |
497,8 |
F-F |
154,6 |
არა |
943,8 |
გაითვალისწინეთ, რომ მნიშვნელობებში ნიშნები არ არის, რადგან ისინი მოდულშია. ეს იმიტომ ხდება, რომ სიგნალი თქვენ მიერ უნდა იყოს მინიჭებული იმის მიხედვით, ბმული გატეხილია თუ ჩამოყალიბებული.
წვის ენთალპია
THE წვის ენთალპია ემსახურება მითითებას ნივთიერების ერთი მოლის წვის დროს გამოთავისუფლებული სითბოს რაოდენობა. უნდა აღინიშნოს, რომ ყოველი წვის რეაქცია ეგზოთერმულია, რადგან ყოველი წვა გამოყოფს სითბოს.
CH4 (g) + 2 O2 (ზ) → CO2 (g) + 2 H2ΔH°ჩ = -889,5 კჯ/მოლ
ქვემოთ მოყვანილი ცხრილი გვიჩვენებს ზოგიერთი ქიმიური ნივთიერების წვის მნიშვნელობების ენთალპიას.
ნივთიერება |
წვის ენთალპია (ΔH°ჩ) კჯ/მოლში |
ეთანოლი - C2ჰ5OH (1) |
-1368 |
ბენზოლი - C6ჰ6 (1) |
-3268 |
ოქტანი - C8ჰ18 (1) |
-5471 |
გლუკოზა - C6ჰ12ო6 (s) |
-2808 |
ფიზიკური მდგომარეობის ცვლილების ენთალპია
ფიზიკური მდგომარეობის ყოველი ცვლილება სითბოს გაცვლას გულისხმობს. ამიტომ, ფიზიკური მდგომარეობის ცვლილების ენთალპია ემსახურება მითითებას სითბოს რაოდენობა, რომელიც მონაწილეობს ფიზიკური მდგომარეობის ცვლილების პროცესებში.
მაგალითად, ჩვენ გვაქვს წყლის აორთქლება:
ჰ2O (1) → H2O (გ) ΔH = +44 კჯ/მოლ
წყლის დნობისას გვაქვს:
ჰ2O(s) → H2O (l) ΔH = +7,3 კჯ/მოლ
ენთალპიის მნიშვნელობები სიმეტრიულია ინვერსიული პროცესებისთვის, რაც ნიშნავს, რომ, მაგალითად, ენთალპიის ცვლილება წყლის გათხევადებაში არის -44 კჯ/მოლი, ხოლო მისი გამაგრებისას უდრის -7,3 კჯ/მოლ.
წაიკითხეთ ასევე: რა არის ენტროპია?
ამოხსნილი სავარჯიშოები ენთალპიაზე
Კითხვა 1 - (UERJ 2018) საწვავად გამოყენებული ნახშირწყალბადების დამაბინძურებელი სიმძლავრე განისაზღვრება გამოთავისუფლებულ ენერგიასა და CO-ს რაოდენობას შორის თანაფარდობით.2 წარმოიქმნება მისი სრული წვის დროს. რაც უფრო მაღალია თანაფარდობა, მით უფრო დაბალია დამაბინძურებლების მოცულობა. ქვემოთ მოცემულ ცხრილში მოცემულია ოთხი ნახშირწყალბადის წვის სტანდარტული ენთალპია.

ცხრილიდან ყველაზე დაბალი დამაბინძურებლობის მქონე ნახშირწყალბადები არის:
ოქტანი
ჰექსანი
ბენზოლი
პენტანი
რეზოლუცია
ალტერნატივა D
კითხვა მიუთითებს იმაზე, რომ დამაბინძურებელი სიმძლავრე განისაზღვრება, როგორც თანაფარდობა (რაოდენობა) გამოთავისუფლებულ ენერგიასა და CO-ს რაოდენობას შორის.2 წარმოიქმნება მისი სრული წვის დროს. რაც უფრო დიდია მიზეზირაც უფრო დაბალია დამაბინძურებლების სიმძლავრე, ანუ მეტი ენერგია გამოიყოფა თითო მოლ CO-ზე2 გენერირებული.
სრული წვის რეაქციები ნახშირწყალბადები ციტირებულია:
ოქტანი: Ç8ჰ18 +25/2 O2 → 8 CO2 + 9 საათი2მიზეზი: 5440/8 = 680
ჰექსანი: Ç6ჰ14 +19/2 O2 → 6 CO2 + 7 საათი2მიზეზი: 4140/6 = 690
ბენზოლი: Ç6ჰ6 + 15/2 O2 → 6 CO2 + 3 სთ2მიზეზი: 3270/6 = 545
პენტანი: Ç5ჰ12 + 8 ო2 → 5 CO2 + 6 H2მიზეზი: 3510/5 = 702
ამრიგად, შეგვიძლია დავასკვნათ, რომ პენტანი არის ყველაზე დაბალი დამაბინძურებლობის მქონე ნახშირწყალბადები.
კითხვა 2 - (Enem 2015) ტყის ნარჩენების გამოყენება ყოველდღიურად უფრო მიმზიდველი ხდება, რადგან ისინი ენერგიის განახლებადი წყაროა. ფიგურა წარმოადგენს ხის ნარჩენებისგან მოპოვებული ბიოზეთის წვას, სადაც ΔH1 ენთალპიის ცვალებადობა ამ ბიოლოგიური ზეთის 1 გ დაწვის გამო, რაც იწვევს ნახშირორჟანგს და თხევად წყალს, და ΔH2 ენთალპიის ცვლილება, რომელიც დაკავშირებულია 1 გ წყლის აირისებრ მდგომარეობაში თხევად მდგომარეობაში გადაქცევაში.

ენთალპიის ცვალებადობა, kJ-ში, 5 გ ამ ბიო-ზეთის დაწვისთვის, რაც იწვევს CO-ს2 (აირიანი) და ჰ2(აირიანი) არის:
ა) -106
ბ) -94
გ) -82
დ) -21.2
ე) -16.4
რეზოლუცია
ალტერნატივა C
ნაჩვენები გრაფიკიდან გვაქვს ΔH1 როგორც ბიოზეთის წვის ენთალპიის ვარიაცია, რომელიც წარმოქმნის CO-ს2 (ზ) და ჰ2O (1) და ΔH2 როგორც წყლის გათხევადების ენთალპიის ცვლილება, ვინაიდან CO2 რჩება აირისებრი და მხოლოდ ფიზიკური მდგომარეობა წყალი ცვლილებები (გაზიდან თხევადში).
სავარჯიშო ითხოვს ენთალპიის ცვლილებას 5 გ ბიოზეთის დაწვისას, რის შედეგადაც წარმოიქმნება CO.2 (აირიანი) და ჰ2O (აირიანი). დიაგრამიდან ეს ენთალპიის ცვლილება შეიძლება განისაზღვროს, როგორც ΔH = ΔH1 – ჰ2. ამრიგად, ΔH-ის მნიშვნელობა იქნება -16,4 კჯ/გ. ეს ვარიაცია, როგორც ჩვენ ვხედავთ ერთეულში, არის ბიო ზეთის თითოეული გრამი. 5 გრამისთვის უნდა გავაკეთოთ პროპორცია:
1გრ ბიოზეთი -16,4კჯ
5გრ ბიოზეთი x
1. x = 5. (-16,4)
x = -82 კჯ
შემდეგ შეგვიძლია მოვნიშნოთ ალტერნატივა C.
სტეფანო არაუხო ნოვაისის მიერ
ქიმიის მასწავლებელი
