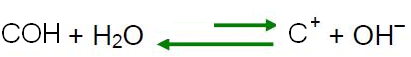
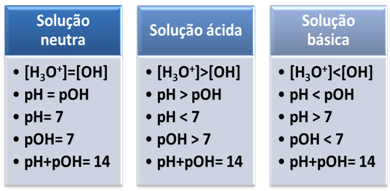
გარემო ითვლება ნეიტრალურად, თუ მას აქვს ჰიდრონიუმის იონების იგივე კონცენტრაცია მოლ/ლ-ში (H3ო+) და ჰიდროქსიდი (OH-).
ნეიტრალური საშუალების მაგალითი, რომელიც სტანდარტადაც კი მოქმედებს სხვა ხსნარებისთვის, არის სუფთა, გამოხდილი წყალი 25ºC ტემპერატურაზე. ამ ტემპერატურაზე მას აქვს ზუსტად 1. 10-7 ორივე იონის მოლ/ლ. ამრიგად, თქვენი იონური პროდუქტი (კვ) უდრის 10-ს-14 (მოლ/ლ)2:
კვ = [ჰ3ო+]. [ოჰ-]
კვ = (1. 10-7 მოლ/ლ). (1. 10-7 მოლ/ლ) = 10-14 (მოლ/ლ)2
pH და pOH მოცემულია ქვემოთ:
pH= - ლოგი [H3ო+] pOH= -log[OH-]
pH= - ჟურნალი 1. 10-7 pOH= - ჟურნალი 1. 10-7
pH = 7pOH = 7
ეს გვაჩვენებს, რომ ნეიტრალურ გადაწყვეტაში, pH უდრის pOH.
- მჟავა საშუალო:
მჟავე გარემოში H იონების კონცენტრაცია3ო+ უფრო დიდია ვიდრე OH იონები-.
ასეთი ხსნარის მიღწევა შესაძლებელია H იონების მცირე ნაწილის დამატებით3ო+მაგალითად, მჟავის საშუალებით.
ლე შატელიეს პრინციპის მიხედვით, როდესაც წონასწორობაში მყოფ სისტემას უქმნის დარღვევას, ის მიდრეკილია საკუთარი თავის მოწესრიგებისკენ, რათა შეამციროს ამ ძალის ზემოქმედება. ეს ნიშნავს, რომ თუ წყალს ემატება მჟავა, H იონები
3ო+ ისინი იქნება ჭარბი და ბალანსი გადაინაცვლებს საპირისპირო რეაქციის მიმართულებით, მარცხნივ. ასე რომ, ეს ჭარბი იონები რეაგირებენ OH იონებთან-. ამრიგად, OH იონების კონცენტრაცია- შემცირდება და ხსნარი გახდება მჟავე.
იონური პროდუქტი (Kw) ყოველთვის უდრის 10-ს-14, მაგრამ H იონების კონცენტრაცია3ო+ მეტია OH იონების კონცენტრაციაზე-1. ამიტომ, pH მეტია, ვიდრე pOH მჟავე გარემოში, მაგრამ მისი ჯამი ყოველთვის უდრის 14-ს.
ასევე, რაც უფრო დიდია H იონების კონცენტრაცია3ო+რაც უფრო დიდია pH მნიშვნელობა. ოთახის ტემპერატურაზე (25°C), pH <7 და pOH > 7.

- ძირითადი საშუალებები:
ძირითად გარემოში, OH იონების კონცენტრაცია- უფრო დიდია ვიდრე H იონების3ო+.
თუ წყალს დავამატებთ ფუძეს, ეს ნიშნავს, რომ ვამატებთ OH იონებს.- და, როგორც წინა პუნქტში იყო ახსნილი, ლე შატელიეს პრინციპით, რეაქციის წონასწორობა წყლის თვითიონიზაცია საპირისპირო მიმართულებით გადავა, ჭარბი იონები რეაგირებენ H იონები3ო+მცირდება თქვენი კონცენტრაცია და ხსნარი ხდება ძირითადი.
ამ შემთხვევაში, pOH იქნება pH-ზე მეტი. ოთახის ტემპერატურაზე (25°C), pH > 7 და pOH < 7.

მოკლედ:
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმიის განხრით
