ძვირფასომოსმენა არის ლაბორატორიული, სამრეწველო ან საშინაო პროცედურა, რომლის დროსაც გარკვეული მოცულობაა გამხსნელი (სუფთა) ემატება ან ამოღებულია (აორთქლების გზით) უკვე არსებული ხსნარიდან.
ნებისმიერ ხსნარში ყოველთვის არის გამხსნელი და მინიმუმ ერთი ხსნადი, როგორც 500 მლ წყლისა და 10 გ წყალში. ნატრიუმის ქლორიდი (NaCl) წარმოდგენილია ქვემოთ:
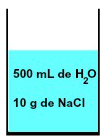
წყლისა და ნატრიუმის ქლორიდის მიერ წარმოქმნილი ნარევის წარმოდგენა
თუ ამ ხსნარს დაემატა 300 მლ წყლის მოცულობა, ამ პროცედურას უწოდებენ განზავება, როგორც ხსნარის მოცულობა იზრდება - ამ შემთხვევაში 800 მლ-მდე, თუმცა, ხსნადი ნივთიერების ოდენობის შეცვლის გარეშე.

განზავება მარილის ხსნარში გამხსნელის დამატებით
განზავება ეს ასევე შეიძლება შესრულდეს ამ მარილიანი ხსნარის (500 მლ წყლისა და 10 გ NaCl )გან გაცხელებით, სანამ, მაგალითად, 300 მლ წყალი არ იქნება ორთქლდება. ამ შემთხვევაში, ხსნარის მოცულობა შემცირდება, თუმცა, ხსნადი ნივთიერება არ შეიცვლება.

განზავება გამხსნელის ორთქლით მარილიან ხსნარში
განზავების პრინციპები:
ხსნარის საბოლოო მოცულობა, როდესაც გამხსნელი ემატება, ყოველთვის უფრო მეტია, ვიდრე საწყისი მოცულობა;
ხსნარის საბოლოო მოცულობა, გამხსნელის ამოღებისას, ყოველთვის უფრო მცირეა, ვიდრე საწყისი მოცულობა;
ხსნადის მასა არასოდეს იცვლება ხსნარის განზავებისას;
ხსნადის მოლის რაოდენობა არასოდეს იცვლება ხსნარის განზავებისას;
როდესაც გამხსნელს ემატება განზავება, საბოლოო ხსნარის კონცენტრაცია ყოველთვის დაბალია, ვიდრე საწყისი ხსნარის კონცენტრაცია;
გამხსნელის განზავების ამოღებისას, საბოლოო ხსნარის კონცენტრაცია ყოველთვის მეტია, ვიდრე საწყისი ხსნარის კონცენტრაცია.
განზავებისას გამოყენებული ფორმულები
The ხსნარის საბოლოო მოცულობის გაანგარიშება:
საბოლოო ხსნარის მოცულობა განზავებაში, რომელშიც ემატება გამხსნელი, გამოითვლება შემდეგი გამოთქმით:
ვვ = Vმე + V
ვვ = საბოლოო ხსნარის მოცულობა
ვმე = საწყისი ამოხსნის მოცულობა
ვ= დამატებული გამხსნელის მოცულობა
თუ განზავებაში ხდება გამხსნელი, საბოლოო მოცულობა გამოითვლება შემდეგი გამოთქმით:
ვვ = Vმე - ვდა
ვდა = აორთქლებული გამხსნელის მოცულობა.
⇒ გაანგარიშება საერთო კონცენტრაცია:
განზავების შემდეგ საბოლოო ხსნარის კონცენტრაცია შეიძლება გამოითვალოს შემდეგნაირად:
ჩმე.Vმე = გვ.Vვ
ჩმე= საწყისი ხსნარის საერთო კონცენტრაცია
ვმე = საწყისი ამოხსნის მოცულობა
ჩვ = საბოლოო ხსნარის მოლარობა ან კონცენტრაცია მოლ / ლ-ში
ვვ= საბოლოო ხსნარის მოცულობა
⇒ გაანგარიშება მოლარობა ან კონცენტრაცია მოლ / ლ-ში:
განზავების შემდეგ საბოლოო ხსნარის მოლარულობა შეიძლება გამოითვალოს შემდეგი გამოთქმით:
მმე.Vმე = მვ.Vვ
მმე= საწყისი ხსნარის მოლარობა ან კონცენტრაცია მოლ / ლ-ში
ვმე = საწყისი ამოხსნის მოცულობა
მვ = საბოლოო ხსნარის მოლარობა ან კონცენტრაცია მოლ / ლ-ში
ვვ= საბოლოო ხსნარის მოცულობა
⇒ ნაყარი სათაურის გაანგარიშება:
საბოლოო ხსნარის სათაური განზავების შემდეგ შეიძლება გამოითვალოს შემდეგი გამოთქმით:
თმე.მმე = თვ.მვ
თმე= საწყისი ამოხსნის სათაური
მმე = საწყისი ხსნარის მასა
თვ = საბოლოო ამოხსნის სათაური
მვ= საბოლოო ხსნარის მასა
რადგან სათაური ასევე შეიძლება გამოითვალოს პროცენტულად და წყალხსნარებში, მასას აქვს იგივე მნიშვნელობა, როგორც მოცულობა, შეგვიძლია გამოვიყენოთ შემდეგი მათემატიკური გამონათქვამი:
პმე.Vმე = პვ.Vვ
ნუ გაჩერდები ახლა... რეკლამის შემდეგ მეტია;)
პმე= საწყისი ამოხსნის პროცენტი
ვმე = საწყისი ამოხსნის მოცულობა
პვ = საბოლოო ამოხსნის პროცენტი
ვვ= საბოლოო ხსნარის მოცულობა
განზავებისას შესრულებული გამოთვლების მაგალითები:
1-ლი მაგალითი - (UFBA) 100 მლ 8% ნატრიუმის ბიკარბონატის ხსნარში 300 მლ წყლის დამატება, მიღებული ხსნარის კონცენტრაციაა:
ა) 24% ბ) 18% გ) 9% დ) 4% ე) 2%
სავარჯიშოებით მოწოდებული მონაცემები:
საწყისი ხსნარის პროცენტი (Pმე) = 8%
ამონახსნის საწყისი მოცულობა (Vმე) = 100 მლ
საბოლოო ხსნარის მოცულობა (Vვ) = 400 მლ (300 მლ – დან 100 მლ – მდე შერევის შედეგი)
საბოლოო ხსნარის პროცენტი (Pვ) = ?
ხსნარის პროცენტული კონცენტრაციის გამოსათვლელად შეგვიძლია გამოვიყენოთ შემდეგი მნიშვნელობებით მოცემული მნიშვნელობები:
პმე.Vმე = პვ.Vვ
8,100 = პვ.400
800 = პვ.400
პვ = 800
400
პვ = 2%
მე -2 მაგალითი - (UFPA) 200 მლ მაგნიუმის ჰიდროქსიდის ხსნარი, მგ (OH)2, მომზადდა წყალში 2,9 გ ფუძის გახსნით. ამ ხსნარის რა მოცულობა უნდა განზავდეს 300 მლ-მდე, რომ მივიღოთ ხსნარი, რომლის მოლარით ტოლია 0.125 მ? მონაცემები: H = 1; მგ = 24; O = 16.
ა) 450 მლ ბ) 150 მლ გ) 400 მლ დ) 300 მლ ე) 900 მლ
სავარჯიშოებით მოწოდებული მონაცემები:
ხსნარის მასა საწყის ხსნარში (მ1) = 2,9 გ
ხსნარის მოცულობა გამოსაყენებლად განზავებისათვის = 200 მლ ან 0.2 ლ (1000-ზე გაყოფის შემდეგ)
ამონახსნის საწყისი მოცულობა (Vმე) რომელიც განზავდება =?
საბოლოო ხსნარის მოცულობა (Vვ) = 300 მლ
მოლარობა ან კონცენტრაცია მოლ / ლ საბოლოო ხსნარში (მ.)ვ) = 0.125 მ
კონცენტრაციის გამოსავლის პროცენტულად გამოსათვლელად უნდა გავაკეთოთ შემდეგი:
Ნაბიჯი 1: გამოთვალეთ ხსნადი ნივთიერების მოლური მასა.
ამისათვის ჩვენ უნდა გავამრავლოთ თითოეული ელემენტის ატომების რაოდენობა მის შესაბამის ატომურ მასაზე და შემდეგ დავამატოთ შედეგები:
მმგ (OH) 2 = 1.24 + 2.16 + 2.1
მმგ (OH) 2 = 24 + 32 + 2
მმგ (OH) 2 = 58 გ / მოლი
ნაბიჯი 2: გამოთვალეთ კონცენტრაცია მოლ / ლ – ში ან საწყისი ხსნარის მოლარობაში:
მმე = მ1
მ.ვ.
მმე = 2,9
58.0,2
მმე = 2,9
11,6
მმე = 0,25 მოლ / ლ
ნაბიჯი 3: განსაზღვრეთ ხსნარის მოცულობა, რომელიც განზავდება მოცემული მნიშვნელობების გამოყენებით და ნაპოვნი შემდეგ გამოხატვაში:
მმე.Vმე = მვ.Vვ
0.25 ვმე = 0,125.300
0.25 ვმე = 37,5
ვმე = 37,5
0,25
ვმე = 150 მლ
მე -3 მაგალითი - (UEG-GO) გაითვალისწინეთ, რომ 100 მლ სპილენძის სულფატის წყალხსნარში, კონცენტრაციით 40 გრ. ლ–1, დაემატა 400 მლ გამოხდილი წყალი. ამ შემთხვევაში, ახალი ხსნარის თითოეულ მლ-ს ექნება მასა, მგ, ტოლი:
ა) 2 ბ) 4 გ) 8 დ) 10
სავარჯიშოებით მოწოდებული მონაცემები:
განზავებას დაემატა წყლის მოცულობა = 400 მლ
ამონახსნის საწყისი მოცულობა (Vმე) = 100 მლ
საბოლოო ხსნარის მოცულობა (Vვ) = 500 მლ (400 მლ – დან 100 მლ – მდე შერევის შედეგი)
საწყისი ხსნარის საერთო კონცენტრაცია (Cმე) = 40 გ. ლ–1
საბოლოო ხსნარის საერთო კონცენტრაცია (Cვ) მგ / მლ =?
ხსნარის კონცენტრაციის მგ / მლ-ში გამოსათვლელად უნდა გავაკეთოთ შემდეგი:
Ნაბიჯი 1: საწყისი ხსნარის კონცენტრაცია გადაიყვანეთ გ / ლ-დან მგ / მლ-ში.
ამისათვის მრიცხველიც და მნიშვნელიც უნდა გავამრავლოთ 1000-ზე და მოცემული კონცენტრაცია გავყოთ 1000-ზე:
ჩმე = 40 გრ 1000
1 ლ 1000
ჩმე = 40 მგ / მლ
ამიტომ, ერთეული გ / ლ და მგ / მლ ერთნაირია.
ნაბიჯი 2: გამოთვალეთ კონცენტრაცია მგ / მლ-ში შემდეგ გამოხატვაში მოცემული მნიშვნელობების გამოყენებით:
ჩმე.Vმე = გვ.Vვ
40,100 = გვ.500
4000 = გვ.500
ჩვ = 4000
500
ჩვ = 8 მგ / მლ
ჩემ მიერ. დიოგო ლოპეს დიასი
გსურთ მიუთითოთ ეს ტექსტი სასკოლო ან აკადემიურ ნაშრომში? შეხედე:
DAYS, დიოგო ლოპესი. "რა არის განზავება?"; ბრაზილიის სკოლა. Ხელმისაწვდომია: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-diluicao.htm. წვდომა 2021 წლის 28 ივნისს.