バッテリーに電圧計を使用すると、2つの電極間の電位差(Uまたはddp)または起電力(emfまたはE)を特定できます。 ただし、この方法で各電極の還元電位または酸化電位を特定することはできません。
科学者は酸化還元プロセスを研究するためにこれらの値を知る必要があったので、彼らは 参照状態. これは、以下の標準条件下で、別の電極に対する各電極の電位を測定することが合意されたことを意味します。
•温度は25°Cでなければなりません。
•1.0気圧での圧力。
•金属を浸す溶液の濃度は1.0mol / Lでなければなりません。
したがって、選択された電極は 水素電極、これは以下に表されます:
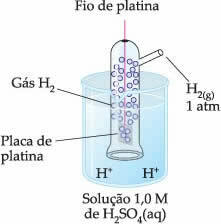
この電極は、水素ガスを入れたチューブ内で、反応に関与しない白金板に接続された白金線で構成され、酸性溶液に浸されています。 この例では、溶液は硫酸でした。
| 慣例により、標準水素電極には値が割り当てられています ゼロ、Eについてはこれだけ0赤 Eは0オキシ. |
したがって、他の電極の電位値を見つけるには、標準水素電極を使用して必要な電極のスタックを構築し、電圧計を使用してddpを測定します。 水素の電位はゼロに等しいため、電圧計に表示される値は、求められている電極の電位になります。
たとえば、亜鉛電極を水素電極と相互接続して、その還元電位を調べます。
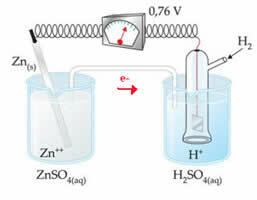
上記のスキームによれば、電圧計は電位差が+0.76(?E0 = +0.76)に等しいと識別しました。 また、亜鉛電極が酸化しているため、アノードになっていることにも注意してください。 そして水素電極が還元され、陰極になりました。
だから私たちは持っています:
?E0 = E0red(カソード)-E0 red(アノード)
0.76 = 0.00-E0赤(Zn)
E0赤(Zn)= 0.00-0.76
E0赤(Zn)= -0.76
負の値は、電子電流が亜鉛電極(アノード)から水素電極に流れ、カソードのように動作することを意味します。 それが正の場合、それは逆になり、水素電極はアノードのように動作します。 これは、銅電極を標準水素電極と相互接続したときに見られます。
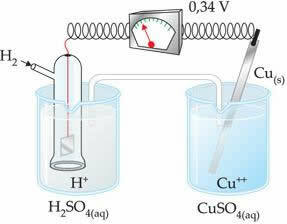
?E0 = E0red(カソード)-E0 red(アノード)
-0.34 = 0.00-E0赤(Zn)
E0赤(Zn)= 0.00 + 0.34
E0赤(Zn)= +0.34
したがって、最も多様な化学種の還元電位と酸化電位を定義することが可能です。 ただし、国際純正応用化学連合(IUPAC)は、還元電位のみの使用を推奨しています。 また、使用する金属に関係なく、バッテリーの表現では、水素電極が常に最初になります。たとえば、次のようになります。
Pt – H2(g)1atm / H3O1 +(aq)1 mol / L // Cu2 +(aq)1 mol / L / Cu
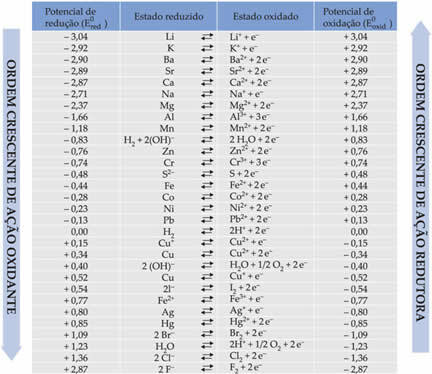
以下の表に、標準水素電極を使用するこの方法で達成される電位と、それぞれの半反応を示します。
ジェニファー・フォガサ
化学を卒業
ブラジルの学校チーム
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/medicao-dos-potenciais-eletroquimicos.htm
