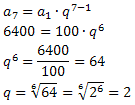塩化物は、陰イオンを含むイオン性化合物です Cℓ-1.
塩素は17または7Aファミリーであり、その原子番号は17に等しく、価電子殻(原子の最も外側の電子殻)に7つの電子があります。 による ルール オクテットの, 安定させるには、この最後のシェルに8つの電子が必要であるため、もう1つの電子を受け取る必要があります。 これが発生すると、つまり、一般に金属とのイオン結合から電子を受け取ると、âが形成されます。塩化ニオン(Cℓ-1)、電子をあきらめた金属は陽イオンになり、形成された物質はイオン性になります。
塩化物は、塩基と塩酸(HCℓ)との反応から生じる塩です。(ここに)). 塩基は陽イオンを提供し、塩酸は塩化物イオンを提供します。
ジェネリック塩基+塩酸 →塩化物+水
ÇOH + HCℓ → ÇCℓ + H2O
塩化物はすべて次のように分類されます 無機塩、水性媒体では、H以外の陽イオンを放出するため+ ヒドロキシル(OH)ではなく、塩化物アニオンを放出します-).
塩化物の命名法は常にこの規則に従います。 塩化物+de +(塩素に関連する元素の名前)。 で あなたの式が形成されます イオン電荷をインデックスに交換する (元素記号の右下にある数字で、結合を形成しているその元素の原子の数を示します)。

もし インデックスは「1」であるため、以下に示すように、数式に記述する必要はありません。
で+1 Cℓ-1 → で1Cℓ1 → でCℓ:塩化ナトリウム;
K+1 Cℓ-1 →KCℓ:塩化カリウム;
ここに+2 Cℓ-1→CaCℓ2:塩化カルシウム;
Ba+2 Cℓ-1→Bここに2:塩化バリウム;
Aℓ+3 Cℓ-1→ACℓ3:塩化アルミニウム。
ただし、テキストで説明されているように「グループのイオン性物質:塩化物、炭酸塩、硝酸塩、硫酸塩」、すべてのイオン性物質と同様に、塩化物は、それらのイオンが互いに引き付け合い、結晶格子を形成するため、本質的に分離された単一の式を持っていません。
私たちが日常生活で持っている塩化物の主な例は 塩化ナトリウム、NaCℓ、 食塩。 その形成(ナトリウムが塩素に電子を提供する)をもたらすイオン結合と、この塩の結晶格子の下を参照してください。

塩化ナトリウムの結晶格子では、各陰イオン Cℓ- 6つの陽イオンに囲まれているNa+ 逆もまた同様なので、この結晶格子の配位数は6です。
すべての塩化物は 固体 周囲条件でかなり 水溶性、私たちの日常生活で見られる最も一般的な塩の1つであり、それらのいくつかを考慮すると ミネラルウォーター、飲料水、水道水、川、海などに溶けて存在します その他。 例外の中には、水不溶性の塩化物である塩化銀(AgCℓ-下の図に示されている)があります。 鉛、銅、水銀化合物。

水不溶性塩化銀*
Cℓイオン-1 私たちが摂取する塩化物から、主に 塩、魚、肉それらは主要な細胞外陰イオンであり、ジュースに存在するため、人体のいくつかの機能にとって重要です 胃、体内の水分分布などの体液を調節し、血漿浸透圧と中性を維持します 電気の。
その欠乏は、不安、下痢、循環器系の問題を引き起こす可能性があります。 その過剰分は、尿(平均して、1人あたり1日あたり約4 gの塩化物を排泄します)、汗、および糞便を介して排泄されます。
*画像クレジット: 著者: ダニーS。 /抽出された画像: ウィキメディアコモンズ
ジェニファー・フォガサ
化学を卒業