O 原子粒子の数を計算する は、任意の原子またはイオンに存在する陽子(原子核内)、電子(電気圏内)、および中性子(原子核内)の量を示すために使用されます。 これを行うには、原子のいくつかの特性を知ることが不可欠です。
1-原子番号(Z)
これは、アトムの頭字語の左下に配置された、大文字のZで表される数学コードです。
Zバツ
原子核の陽子の数(p)と原子のエレクトロスフィアの電子の数(e)を示します。 したがって、一般的には:
Z = p = e
2-質量数(A)
これは、任意の原子の原子核に存在する陽子(p)と中性子(n)の数の合計に対応する数学的コードです。 質量数を表す方程式は次の式で与えられます。
A = p + n
陽子の数は原子番号と等しいので、次のように質量数を計算する方程式を書くことができます。
A = Z + n
原子の質量数と原子番号がわかれば、次のように中性子の数を求めることができます。
n = A-Z
3- イオン
それらは、電子を失ったり、獲得したりする原子です。 次のモデルのように、表現の右上に正または負の記号が配置されています。
バツ+ またはX-
陽イオン:これは陽イオンと呼ばれ、正の符号は電子を失ったことを示します。
マイナスイオン:これは陰イオンと呼ばれ、マイナス記号は電子を獲得したことを示します。
今やめないで... 広告の後にもっとあります;)
4- 原子の類似性
a)同位体
原子番号が同じで質量数が異なる原子。 例:
7バツ14 そして 7Y16
原子XとYの原子番号は同じ(頭字語の左側)、つまり7です。 原子Xの質量数(頭字語の右側)は14に等しく、原子Yの質量数は16に等しくなります。
b)同重体
質量数が同じで原子番号が異なる原子。 例:
15バツ31 そして 13Y31
原子XとYの質量数(頭字語の右側)は31です。 一方、原子Xの原子番号は15で、原子Yの原子番号は13です。
c)アイソトーン
質量数と原子番号が異なるが、中性子の数が同じである原子。
d)アイソエレクトロニクス
同じ数の電子を持つ原子。 例:
12バツ+2 そして 7Y-3
原子Xの原子番号は12に等しく、陽イオン(正電荷+2)であるため、2つの電子を失い、その電球に10個の電子があります。 一方、原子Yは、原子番号が7で、陰イオン(負の電荷が-3)であるため、3つの電子を獲得し、その電球に10個の電子を持ちます。
マインドマップ:原子粒子
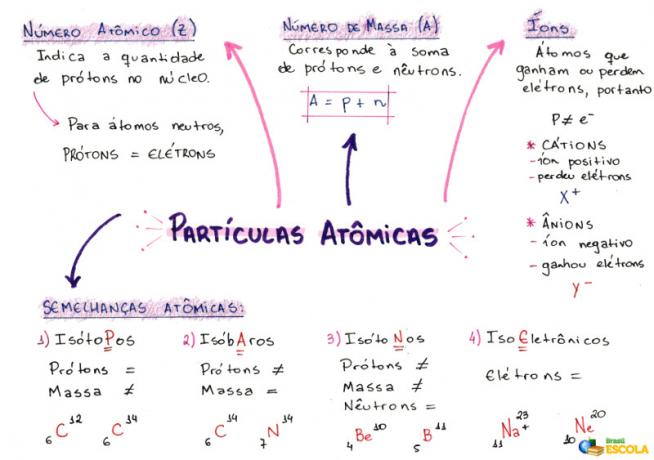
*マインドマップをPDFでダウンロードするには、 ここをクリック!
原子粒子の数を計算する例
例1: 原子内の陽子、中性子、電子の数を決定します 14バツ29.
原子Xには次の値が与えられました:
質量数(右上)= 29
原子番号(左下)= 14
陽子の数を決定するには:
陽子の数は常に原子番号と等しいので、X原子には14個の陽子があります。
電子の数を決定するには:
原子Xはイオンではないため、電子の数は陽子の数、つまり14に等しくなります。
中性子の数を決定するには:
中性子の数は、次の式の質量と陽子の数を使用して決定されます。
A = p + n
29 = 14 + n
29-14 = n
n = 15
例2: イオンXの陽子、中性子、電子の数を決定します+3、それらの質量数と原子番号がそれぞれ51と23であることを知っています。
イオンXには次の値が与えられました:
質量数= 51
原子番号(左下)= 23
陽子の数を決定するには:
陽子の数は常に原子番号と等しいので、X原子には23個の陽子があります。
電子の数を決定するには:
イオンXは正(+3)であるため、3つの電子を失った陽イオンです。 したがって、その電子の数は20です。
注意: 電子数の減少または増加は、常に原子番号に関連して発生します。
中性子の数を決定するには:
中性子の数は、次の式の質量と陽子の数を使用して決定されます。
A = p + n
51 = 23 + n
51-23 = n
n = 28
例3: 原子Wは、それぞれ29と57に等しい原子番号と質量を持ち、 原子番号が30の原子Yは、質量数が 65. この情報を使用して、原子Bの陽子、中性子、および電子の数を決定します。
演習で提供されたデータ:
アトムW
原子番号(左下)= 29
質量数(右上)= 57
Y同重体、つまりYの質量も57です。
Y原子
原子番号= 30
質量数= 57
これらの2つの値を使用して、元素Bの同中性子体であるため、その中性子数を決定する必要があります。
A = Z + n
57 = 30 + n
57-30 = n
n = 27
アトムB:
質量数= 65
中性子の数= 27
これらのデータを使用して、原子番号を決定する必要があります。これにより、陽子の数と電子の数を決定することになります(イオンではないため)。
A = Z + n
65 = Z +27
65-27 = Z
Z = 38
したがって、原子Bには、38個の陽子、38個の電子、27個の中性子があります。
*ビクターリカルドフェレイラによるマインドマップ
化学の先生
私によって。DiogoLopesDias


