
לפעמים זה יכול לקרות נוסחה מינימלית להיות זהה לנוסחה המולקולרית של התרכובת; עם זאת, זה לא תמיד נכון.
לדוגמא, הנוסחה האמפירית או המינימלית למים היא H2O, המציין שיש יחס 2: 1 בין היסודות המרכיבים מולקולות מים. ובמקרה, זו גם הנוסחה המולקולרית של מים. עם זאת, כדי לראות שזה לא תמיד קורה, עיין בשתי הדוגמאות הבאות:
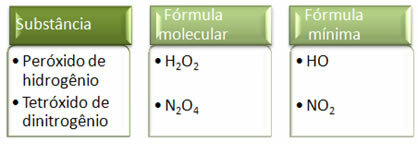
מכיוון שהנוסחה המינימלית היא רק היחס בין האטומים של כל יסוד ולא הכמות בפועל בנוסחה המולקולרית, היא יכולה להתרחש של תרכובות שונות בעלות אותה נוסחה אמפירית ואפילו הנוסחה המינימלית של תרכובת יכולה להיות זהה לנוסחה המולקולרית של אַחֵר. שים לב, בדוגמה שלהלן, כיצד זה יכול לקרות:
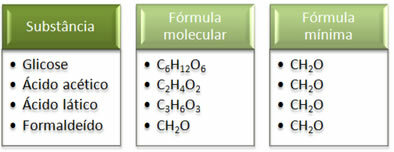
ראה כי הנוסחה המינימלית CH2זהה לכל החומרים, כלומר הנוסחה המינימלית הזו מבטאת את זה, בכל המקרים אטומי פחמן, מימן וחמצן נמצאים בנוסחאות מולקולריות ביחס של 1:2:1. יתר על כן, היחיד שיש לו אותה נוסחה מולקולרית כמו הנוסחה האמפירית הוא פורמלדהיד.
- חישוב הנוסחה המינימלית או האמפירית:
כדי לקבוע את הנוסחה האמפירית של תרכובת, ראשית יש לדעת מהו אחוזה או נוסחתה הקרובה. ניתן לעשות זאת על ידי מדידת המסה של כל אלמנט ב 100 גרם מדגם. הטקסט "אחוז או נוסחה Centesimal"מבהיר את העניין הזה טוב יותר.
לדוגמא, נניח שההרכב הקרוב של תרכובת נתונה ניתן על ידי: 40.00% C, 6.67% H ו- 53.33% O. אנו מעבירים ערכים אלה לגרמים, בהתחשב במסה של 100 גרם מדגם קומפוסט. לפיכך, יש לנו: 40 גרם של C, 6.67 גרם של H ו- 53.33 גרם של O.
כעת יש צורך להעביר את הערכים הללו לכמות החומר (mol). אנו עושים זאת על ידי חלוקת כל אחד מהערכים שנמצאו לפי המסה הטוחנת בהתאמה:
ג: 40/12 = 3.33
H: 6.67 / 1 = 6.67
O: 53.33 / 16 = 3.33
מכיוון שהערכים אינם מספרים שלמים, אנו משתמשים במכשיר הבא: אנו מחלקים את כל הערכים בקטן שבהם, כך שהפרופורציה ביניהם לא תשתנה.
במקרה זה, הערך הקטן ביותר הוא 3.33, כך שהתוצאה תהיה:
ג: 3.33 / 3.33 = 1
H: 6.67 / 3.33 = 2
O: 3.33 / 3.33 = 1
לפיכך, הנוסחה המינימלית של חומר לא ידוע זה שווה ל: Ç1ה2או1 אוֹ CH2או.
בקצרה, הצעדים הדרושים למציאת הנוסחה האמפירית או המינימלית של חומר הם:

מאת ג'ניפר פוגאצה
בוגר כימיה
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm
