Nella vita di tutti i giorni e nei laboratori ci sono reazioni e trasformazioni spontanee e altre non spontanee. Ad esempio, tutta la combustione è una reazione spontanea, perché una volta avviata, continuerà fino a quando tutto il carburante non sarà consumato o fino a quando tutto l'ossigeno non sarà esaurito.
D'altra parte, l'elettrolisi è un processo non spontaneo, in cui l'energia elettrica viene trasformata in energia chimica. Un esempio è l'elettrolisi del cloruro di sodio (NaCl). Quando una corrente elettrica viene fatta passare su questo sale fuso, si hanno reazioni redox e formazione di sodio metallico (Na(S)) e cloro gassoso (Cl2(g)). Se smettiamo di far funzionare la corrente elettrica, la reazione non continuerà da sola, il che dimostra che non è spontanea.
La spontaneità di una reazione può essere misurata usando il Equazione di Gibbs-Helmholtz, indicato di seguito:

Su cosa:
∆G = variazione di energia libera;
∆H = variazione di entalpia;
T = temperatura in Kelvin (sempre positiva);
∆S = variazione di entropia.
Questa equazione prende il nome perché proposta dal fisico americano J. Willard Gibbs (1839-1903) e dal fisico tedesco Hermann Helmholtz (1821-1894).
Per capire meglio come questa equazione ci aiuta a determinare la spontaneità di una reazione, esaminiamo brevemente ciascuno dei concetti coinvolti in essa:
- ∆H (variazione di entalpia): L'entalpia (H) è il contenuto energetico di una sostanza. Finora, non è noto alcun modo per determinarlo. In pratica, ciò che si ottiene è misurare la variazione di entalpia (∆H) di un processo, utilizzando i calorimetri. Questa variazione è la quantità di energia che è stata rilasciata o assorbita nel processo.
- ∆S (variazione di entropia):L'entropia (S) è la quantità termodinamica che misura il grado di disordine in un sistema.
Ad esempio, nello scioglimento del ghiaccio, le molecole si spostano da uno stato solido a uno liquido, dove c'è una maggiore disorganizzazione. Ciò significa che in questo processo l'entropia è aumentata (∆S > 0).
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Nella produzione di ammoniaca (NH3), 1 mole di azoto gassoso reagisce con 3 moli di idrogeno gassoso (cioè 4 moli di molecole nei reagenti), dando luogo a 2 moli di ammoniaca:
no2(g) +3 H2(g) → 2 NH3(g)
Poiché il numero di molecole nella fase gassosa diminuisce in questo processo, la disorganizzazione è diminuita, il che significa che anche l'entropia è diminuita (∆S< 0).
- ∆G (Energia libera): Energia gratuita o Energia libera di Gibbs (perché è stato proposto solo da questo scienziato nel 1878) is l'energia utile del sistema che viene utilizzata per svolgere il lavoro.
Un sistema ha energia globale, ma solo una frazione di quell'energia sarà usata per fare lavoro, questa è chiamata energia libera di Gibbs, simboleggiata da G.
Secondo Gibbs, un processo è considerato spontaneo se esegue lavoro, cioè se G diminuisce. In questo caso, lo stato finale della trasformazione sarà più stabile di quello iniziale quando ∆G < 0.
Sulla base di ciò, possiamo concludere quanto segue:

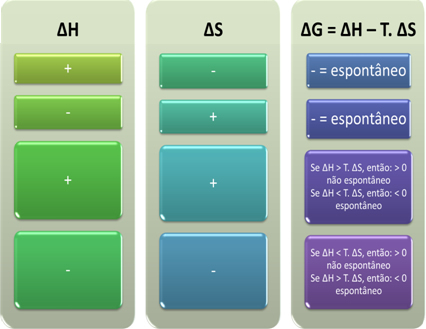
Possiamo anche vedere se un processo sarà spontaneo osservando il segno algebrico di ∆H e ∆S nell'equazione di Gibbs-Helmholtz:
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Energia libera di Gibbs"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm. Consultato il 28 giugno 2021.



