Lo scienziato Friedrich Kohlrausch (1840-1910) fu il primo a proporre che l'acqua pura conduca elettricità, anche se su piccola scala. Questo perché l'acqua si comporta in modo anfotero; cioè in certe occasioni agisce come acido, donando protoni (H+); e in altri si comporta come una base, ricevendo protoni.
Ciò significa che l'acqua esegue la propria ionizzazione, secondo l'equazione chimica mostrata di seguito:
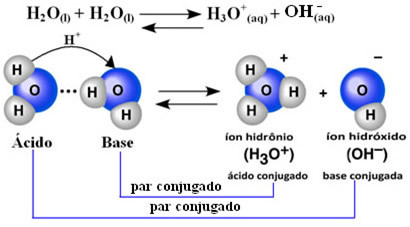
Questo processo si chiama autoionizzazione dell'acqua e avviene su scala molto ridotta, cioè l'acqua è un elettrolita molto debole, con bassi valori di grado di ionizzazione e costante di ionizzazione all'equilibrio (Kç). Questo è esattamente il motivo per cui l'acqua ha una conduttività così bassa.
Per avere un'idea, ad una temperatura ambiente di 25°C è possibile determinare che le concentrazioni di ioni idrossido e idronio prodotti nell'autoionizzazione dell'acqua pura sono pari a 1. 10-7 moli l-1. Ciò significa che su un miliardo di molecole d'acqua, solo due ionizzano.
La costante di equilibrio ionico dell'acqua si chiama
çcostante di dissociazione dell'acqua,costante di autoprotolisio prodotto ionico dell'acqua.Questa costante è rappresentata da Kw, perché la w si riferisce alla parola acqua, che in inglese significa acqua.Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Il suo calcolo si effettua allo stesso modo delle altre costanti di equilibrio, ricordando che, come recita il testo "Costanti di Balance Kc e Kp”, in questo caso nell'espressione compariranno solo i prodotti, perché l'acqua allo stato liquido ha la stessa attività a 1. Le sostanze pure liquide o solide non vengono messe nell'espressione della costante di dissociazione perché non cambiano. Vengono poste solo soluzioni acquose e gassose. Quindi abbiamo:
Kw = [H3oh+]. [Oh-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
Come per le altre costanti di equilibrio, okw cambia solo con il cambio di temperatura. All'aumentare della temperatura dell'acqua, aumenta anche la sua ionizzazione, il che significa che l'autoionizzazione dell'acqua è un processo endotermico, cioè assorbe calore.
Questo può essere visto nei valori del prodotto ionico dell'acqua (Kw) riportati nella tabella sottostante a diverse temperature:
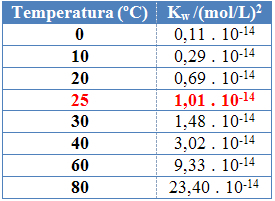
Il prodotto ionico dell'acqua avrà sempre un valore fisso ad ogni temperatura, sia in acqua pura che in soluzione. Anche se la soluzione ha concentrazioni di ioni H3oh+ e oh- diverso, il prodotto tra di loro rimarrà costante.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Prodotto ionico dell'acqua (Kw)"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm. Consultato il 28 giugno 2021.


