Perché avvenga una reazione chimica è necessario soddisfare quattro condizioni fondamentali, che sono:
1. I reagenti devono contattare;
2. Ci deve essere affinità chimica tra i reagenti;
3. Le collisioni tra le particelle di reagente devono essere efficaci;
4. L'energia di attivazione deve essere raggiunta.
Vedi brevemente ogni caso:
1.Contatto tra i reagenti:
Questa condizione è ovvia, perché anche se i reagenti hanno molta affinità tra loro, come nel caso di acidi e basi, se sono separati, la reazione non avverrà. Hanno bisogno di entrare in contatto in modo che le loro particelle possano scontrarsi, rompendo i legami dei reagenti e formando i legami dei prodotti.

2.Affinità chimica:
Come abbiamo visto, portare a contatto i reagenti è necessario, ma non sufficiente. Ad esempio, se mettiamo il sodio a contatto con l'acqua, si verificherà una reazione estremamente violenta, ma se mettiamo l'oro, non vedremo alcuna differenza. Questo perché sostanze diverse hanno affinità chimiche diverse tra loro o potrebbero non avere alcuna affinità. Maggiore è l'affinità chimica, più veloce è la reazione.
Negli esempi citati, il sodio ha una grande affinità con l'acqua, tanto che per non entrare in contatto con l'umidità dell'aria, il sodio metallico viene immagazzinato nel cherosene. L'oro è inerte, motivo per cui i monumenti d'oro durano così a lungo, come i sarcofagi d'Egitto.

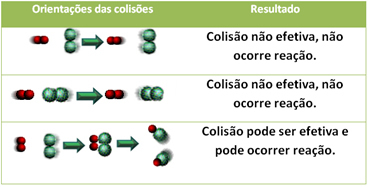
3.Teoria delle collisioni:
Anche nei composti che hanno affinità chimica, perché la reazione abbia luogo è necessario che le loro particelle, atomi o molecole si scontrino efficacemente. Non tutte le particelle che si scontrano lo fanno in modo efficace, ma gli urti che provocano la rottura del i legami reagenti e la formazione di nuovi legami sono quelli che si verificano con l'orientamento corretto e con l'energia abbastanza.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Di seguito è mostrato il caso di due collisioni inefficaci e una collisione effettiva che provoca la reazione.
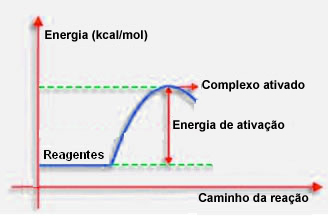
4.Energia di attivazione e complesso attivato:
Come affermato nel punto precedente, una collisione effettiva, oltre a una guida favorevole, richiede anche energia sufficiente. La quantità minima di energia necessaria affinché ogni reazione abbia luogo è chiamata energia di attivazione.
Se i reagenti hanno un'energia uguale o maggiore dell'energia di attivazione, durante lo shock ben orientato, si formerà un complesso inizialmente attivato, che è una struttura intermedia tra i reagenti e il prodotti. Nel complesso attivato, ci sono legami reagenti indeboliti e nuovi legami prodotto che si formano.
Pertanto, l'energia di attivazione funziona come una sorta di barriera affinché la reazione si verifichi, perché più è grande, più sarà difficile che si verifichi la reazione. In alcuni casi è necessario fornire energia ai reagenti. Ad esempio, il gas di cottura ha un'affinità per interagire con l'ossigeno nell'aria, ma abbiamo bisogno di fornire energia quando mettiamo insieme il fiammifero, altrimenti la reazione non avviene. Ma una volta iniziata, la reazione stessa rilascia energia sufficiente per attivare le altre molecole e far continuare la reazione.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Condizioni per il verificarsi di reazioni chimiche"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm. Consultato il 27 giugno 2021.



