oh Diagramma delle fasi è un grafico che permette di definire in quale stato fisico si trova una sostanza in un dato momento, conoscendone la temperatura e la pressione.
Le misurazioni di laboratorio vengono utilizzate per costruire il diagramma di fase di una determinata sostanza.
Il diagramma è diviso in tre regioni, che rappresentano lo stato solido, liquido e vapore.
I punti sulle linee che delimitano queste regioni indicano i valori di temperatura e pressione che la sostanza può essere in due stati.
Un diagramma di fase ha i seguenti elementi:
- curva di Fusione: separa le aree che corrispondono allo stato solido e liquido.
- curva di vaporizzazione: separa le aree corrispondenti alle fasi liquida e vapore.
- curva di sublimazione: separa le aree corrispondenti alle fasi solida e vapore.
- punto triplo: punto di intersezione delle tre curve (fusione, vaporizzazione e sublimazione). Questo punto indica i valori di temperatura e pressione che la sostanza può avere contemporaneamente nei tre stati.
- Punto critico: indica la temperatura massima a cui la sostanza è vapore. Da quel momento in poi, non è più possibile distinguere tra stato liquido e stato di vapore. A temperature superiori al punto critico, la sostanza diventa un gas.
Nella figura seguente, presentiamo una rappresentazione di un diagramma di fase:

Leggi di più su: Cambiamenti di stato fisico.
curva di fusione
Le sostanze, in genere, aumentano di volume quando vanno incontro a fusione e, al contrario, diminuiscono di volume quando si solidificano. Di conseguenza, un aumento della pressione porta ad un aumento del punto di fusione (temperatura di fusione).
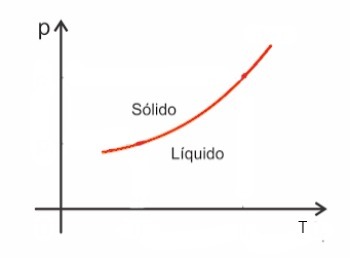
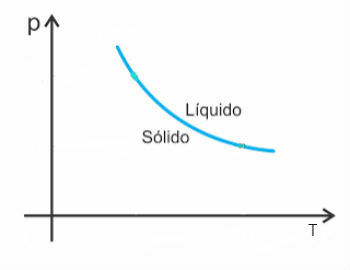
Tuttavia, ci sono alcune eccezioni tra loro l'acqua, che in fusione diminuisce di volume. In questo caso, un aumento della pressione provoca una diminuzione del punto di fusione.
Pertanto, la curva di fusione di queste sostanze sarà simile a questa:
Esempio
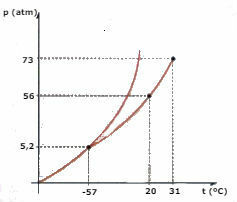
Considera il diagramma di fase CO2 (anidride carbonica) rappresentato di seguito e rispondere alle domande:
a) In che fase è la CO2 , quando la tua temperatura è -60 °C e la pressione è 50 atm?
b) Una certa quantità di CO2 il liquido è sottoposto ad una pressione di 56 atm, ed è confinato in un contenitore. Se il liquido viene riscaldato, mantenendo la pressione costante, qual è il valore di temperatura a cui avverrà la vaporizzazione?
c) Qual è il valore di temperatura e pressione del punto triplo della CO2?
d) Un pezzo di ghiaccio secco (CO2) è sottoposto ad una pressione di 2 atm. Viene riscaldato, mantenendo una pressione costante. Ad un certo momento inizia a verificarsi un cambiamento di fase. Come si chiama questo cambiamento?
Risoluzione:
a) Osservando il diagramma, concludiamo che la CO2 sarà in fase solida.
b) La vaporizzazione avverrà quando la temperatura raggiunge i 20°C.
c) Il punto triplo corrisponde all'intersezione delle tre curve, nel caso di CO2, quando ha una temperatura di -57°C e una pressione di 5,2 atm, i tre stati fisici possono coesistere.
d) Avverrà la sublimazione
Per saperne di più leggi anche:
- solidificazione
- Punto di fusione e di ebollizione
- Evaporazione
- Condensazione
Esercizi risolti
1) Nemico - 2000
Ancora oggi è molto diffuso l'utilizzo di contenitori di argilla (vasi o vasi di ceramica non smaltata) per conservare l'acqua a una temperatura inferiore a quella dell'ambiente. Questo è perché:
a) l'argilla isola l'acqua dall'ambiente, mantenendola sempre a una temperatura inferiore alla propria, come se fosse polistirolo.
b) l'argilla ha il potere di “congelare” l'acqua grazie alla sua composizione chimica. Nella reazione, l'acqua perde calore.
c) l'argilla è porosa e lascia passare l'acqua. Una parte di quest'acqua evapora, sottraendo calore alla moringa e il resto dell'acqua, che viene poi raffreddata.
d) l'argilla è porosa, permettendo all'acqua di depositarsi all'esterno della brocca. L'acqua esterna è sempre ad una temperatura più alta di quella interna.
e) La Moringa è una sorta di frigorifero naturale, che rilascia sostanze igroscopiche che abbassano naturalmente la temperatura dell'acqua.
Alternativa c: l'argilla è porosa e lascia passare l'acqua. Una parte di quest'acqua evapora, sottraendo calore alla moringa e il resto dell'acqua, che viene poi raffreddata.
2) Ita - 2013
Si consideri l'ipotetico diagramma di fase rappresentato schematicamente nella figura seguente:

Cosa rappresentano i punti A, B, C, D ed E?
punto A: punto di sublimazione
punto B: punto triplo
Punto C: punto di fusione/solidificazione
punto D: punto di vaporizzazione/condensazione
punto E: punto critico
3) UECE - 2009
Guardando il diagramma di fase PT mostrato di seguito. Si può concludere, correttamente, che una sostanza che ha attraversato il processo di sublimazione segue la traiettoria:

a) X o Y
b) Y o U
c) U o V
d) T o X
Alternativa b: Y o U


