IL Cinetica chimica è un campo che studia i fattori che influenzano la velocità di sviluppo delle reazioni chimiche, cioè la velocità con cui avvengono. C'è sempre più ricerca intorno a quest'area, poiché spesso vogliamo accelerare alcune reazioni o rallentarne altre. Ciò è particolarmente importante per le industrie e questa ricerca ha importanti conseguenze tecnologiche.
Ma poiché la velocità di una reazione può variare ad ogni intervallo di tempo e da una sostanza all'altra, è consuetudine calcolare il velocità di reazione media.
Considera la seguente reazione generica, dove i coefficienti sono lettere minuscole e reagenti e prodotti sono rappresentati da lettere maiuscole:
a A + b B → c C + d D
Verrà data la velocità media di questa reazione dividendo la velocità media di reazione di una qualsiasi delle sostanze reagenti o la velocità media di formazione di uno qualsiasi dei prodotti per il rispettivo coefficiente nell'equazione chimica. Questo è dato da:
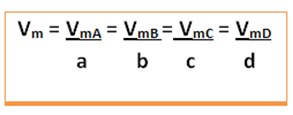
Ad esempio, si consideri la reazione di decomposizione del perossido di idrogeno:
2 ore2oh2(ac) → 2 ore2oh(1) + 1 O2 (g)
Diciamo che in 1 minuto si sono formati 0,3 mol/L di H2O e 0,15 mol/L di O2, mentre 0,3 mol/L di H si sono decomposti2oh2, ovvero le velocità medie di decomposizione e formazione di queste sostanze nella reazione sono:
VmH2O2 = 0,3 mol/l. min
VmH2O = 0,3 mol/l. min
VmO2 = 0,15 mol/l. min
La velocità media della reazione globale si troverà prendendo uno di questi valori e dividendolo per il rispettivo coefficiente nell'equazione:
Vm = VmH2O2 = 0,3 mol/l. min = 0,15 mol/l. min
2 2
Vm = VmH2O = 0,3 mol/l. min = 0,15 mol/l. min
2 2
Vm = VmO2 = 0,15 mol/l. min = 0,15 mol/l. min
1 1
Si noti che i tre valori sono uguali, quindi la velocità di reazione è la stessa in funzione di qualsiasi reagente o prodotto, nello stesso intervallo di tempo.
Tuttavia, come sono stati trovati i valori delle velocità medie di ciascuna delle sostanze coinvolte in queste reazioni?
Si può calcolare dividendo la variazione di concentrazione della sostanza (reagente o prodotto) per l'intervallo di tempo. Se vogliamo determinare la velocità media di uno dei of reagenti della reazione, dovremo mettere a segno negativo prima, oppure considerare il valore di concentrazione nel modulo ||, poiché, poiché la concentrazione del reagente diminuisce nel tempo, il valore della velocità sarebbe negativo, ma non c'è velocità negativa.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)

Ad esempio, si consideri la seguente reazione di decomposizione del gas ozono (O3(g)) in ossigeno gassoso (O2(g)):
2 O3(g) → 3 O2(g)
Diciamo che in un pallone c'erano 10 moli di ozono, ma dopo 1 minuto ne erano rimaste solo 4 moli; questo significa che 6 moli di ozono si sono trasformate in gas ossigeno. Quindi abbiamo:
2 O3(g) → 3 O2(g)
t = 0 min 2 mol/L 0 mol/L
spese formate
6 mol/L 9 mol/L
t = 1 min 4 mol/L 9 mol/L
Si noti che poiché il rapporto di reazione è 2:3, quindi se sono state utilizzate 6 moli di O3, si sono formate 9 moli di O2. Quindi, dopo 1 minuto, abbiamo le seguenti velocità medie:
Vm = - [Il3]
t
Vm = - ([O3finale - oh3iniziale])
tFinale - tiniziale
Vm = - ([4 - 10])
1– 0
Vm = 6 mol/l. min→ Per 1 minuto hanno reagito 6 moli di ozono in ogni litro di sistema.
Vm = [Il2]
t
Vm = ([O2finale - oh2iniziale])
tFinale - tiniziale
Vm = ([9 - 0])
1– 0
Vm = 9 mol/l. min→ Durante 1 minuto, si sono formate 9 moli di ossigeno in ogni litro del sistema.
Questo ci mostra che possiamo calcolare la velocità media in funzione dei reagenti o in funzione dei prodotti.
Ora, se vogliamo calcolare la velocità media di questa reazione globale, facciamo come abbiamo mostrato all'inizio: dividiamo ciascuna di queste velocità per i rispettivi coefficienti nell'equazione chimica:
Vm = VmO3 = 6 mol/l. min = 3 mol/l. min
2 21
Vm = VmO2 = 9 mol/l. min = 3 mol/l. min
3 3
Vm = VmO3 = VmO2
23
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Velocità delle reazioni chimiche"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm. Consultato il 27 giugno 2021.