IL ossidazione e il riduzione sono reazioni che si verificano quando c'è a trasferimento di elettroni tra specie chimiche. Sono reazioni opposte: in un'ossidazione c'è una perdita di elettroni e in una riduzione c'è un guadagno di elettroni.
Questi processi avvengono simultaneamente, perché quando una sostanza dona elettroni ad un'altra si ossida, mentre la sostanza che riceve elettroni subisce una riduzione.
Quando una sostanza si ossida provoca la riduzione delle altre specie, da cui il nome di agente riducente. Allo stesso modo, una sostanza si riduce a causa dell'ossidazione di un'altra ed è quindi l'agente ossidante.
Le reazioni di ossidazione e riduzione sono dimostrate dalla variazione del numero di ossidazione (nox) delle specie coinvolte.
Generalmente una reazione che presenta ossidazione e riduzione può essere rappresentata da:
A+B+ → A+ + B
Dove,
A: sostanza che si ossida, perde elettroni, aumenta il suo valore ed è l'agente riducente.
B: sostanza che subisce riduzione, acquista elettroni, diminuisce l'ossidazione ed è l'agente ossidante.
Esempi di ossidazione e riduzione
Vedere l'immagine seguente per un esempio dell'equazione chimica redox.
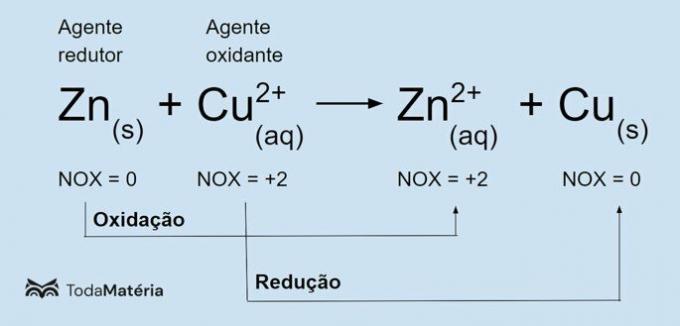
Lo zinco metallico subisce ossidazione e provoca la riduzione del rame, quindi è l'agente riducente. Il suo numero di ossidazione (nox) aumenta da 0 a +2 perché perde 2 elettroni.
Lo ione rameico (Cu2+) subisce una riduzione e provoca l'ossidazione del rame, quindi è l'agente ossidante. Il suo numero di ossidazione (nox) diminuisce da +2 a 0 perché guadagna 2 elettroni e diventa rame metallico, che è elettricamente neutro.
Altri esempi di reazioni redox nella vita di tutti i giorni sono:
combustione di metano
CH4(g) + 2O2(g) → CO2(g) + 2 ore2o(v)
Fotosintesi
6CO2(g) + 6 ore2o(v) → C6H12o6(qui) + 6O2(g)
corrosione del ferro
2Fe(S) + 3/4O2(g) + 3 ore2o(v) → 2Fe (OH)3(i) (ruggine Fe2o3.3H2O)
Impara di più riguardo numero di ossidazione (nox).
Come avvengono le reazioni di ossidazione e riduzione?
L'equazione della reazione redox che coinvolge rame e zinco può essere rappresentata da semireazioni, come mostrato di seguito.
- semireazione di ossidazione: Zn0(S) → 2e- + Zn2+(qui)
- Semireazione di riduzione: culo2+(qui) + 2e- → culo0(S)
- equazione globale: Zn0(S) + culo2+(qui) → Zn2+(qui) + culo0(S)
Questo trasferimento di elettroni nella reazione redox avviene in base al potenziale di riduzione delle specie coinvolte. Il componente con il potenziale di riduzione più basso tende a donare elettroni, mentre quello con il potenziale più alto li riceverà.
Ad esempio, lo zinco ha un potenziale di riduzione di -0,76 V, mentre il rame ha un potenziale di riduzione di +0,34 V. Pertanto, lo zinco, poiché ha un potenziale di riduzione inferiore, è un agente riducente migliore e favorisce la riduzione rame, che ha un potenziale di riduzione più elevato e, quindi, guadagna elettroni e provoca l'ossidazione dello zinco.
Leggi anche su reazioni redox.
Esercizi su ossidazione e riduzione
Usa le seguenti domande per testare la tua conoscenza di ciò che hai imparato in questo testo.
domanda 1
Per quanto riguarda le reazioni di ossidazione e riduzione, è corretto affermare che
a) L'aumento del nox della specie chimica indica che ha subito una riduzione.
b) La sostanza che perde elettroni subisce ossidazione ed è un agente ossidante.
c) Nelle reazioni redox, gli elettroni vengono trasferiti.
d) La sostanza che guadagna elettroni è ridotta ed è un agente riducente.
e) La diminuzione del nox della specie chimica indica che ha subito ossidazione.
Alternativa corretta: c) Nelle reazioni di ossido-riduzione, avviene il trasferimento di elettroni.
Nelle reazioni redox, gli elettroni vengono trasferiti.
La sostanza che acquista elettroni subisce una riduzione ed è l'agente ossidante. La diminuzione del nox delle specie chimiche indica che è stato ridotto.
La sostanza che perde elettroni subisce ossidazione ed è un agente riducente. L'aumento del nox della specie chimica indica che ha subito ossidazione.
Domanda 2
Esempi di reazioni redox nella vita quotidiana TRANNE
a) Corrosione
b) combustione
c) Fotosintesi
d) Neutralizzazione
Alternativa errata: d) Neutralizzazione.
Una reazione di neutralizzazione è quella che si verifica tra un acido e una base, risultando in sale e acqua. Per esempio:
NaOH + HCl → NaCl + H2o
Esempi di una reazione redox sono:
combustione di metano
CH4(g) + 2O2(g) → CO2(g) + 2 ore2o(v)
Fotosintesi
6CO2(g) + 6 ore2o(v) → C6H12o6(qui) + 6O2(g)
corrosione del ferro
2Fe(S) + 3/4O2(g) + 3 ore2o(v) → 2Fe (OH)3(i)
Domanda 3
Osservare le seguenti reazioni di ossidoriduzione e indicare quali sono gli agenti ossidanti e riducenti.
IO. Zn0(S) + culo2+(qui) → Zn2+(qui) + culo0(S)
II. Culo2+(qui) + H2(g) → 2 ore+(qui) + culo(S)
III. Zn(S) + 2 ore+(qui) → Zn2+(qui) + H2(g)
Rispondere:
In una reazione redox, quello che subisce l'ossidazione è l'agente riducente e quello che subisce la riduzione è l'agente ossidante.
IO. Zn0(S) + culo2+(qui) → Zn2+(qui) + culo0(S)
Agente ossidante: rame (Cu)
Agente riducente: zinco (Zn)
II. Culo2+(qui) + H2(g) → 2 ore+(qui) + culo(S)
Agente ossidante: rame (Cu)
Agente riducente: idrogeno (H)
III. Zn(S) + 2 ore+(qui) → Zn2+(qui) + H2(g)
Agente ossidante: idrogeno (H)
Agente riducente: zinco (Zn)
Acquisisci maggiori conoscenze con i contenuti:
- Cosa sono le pile?
- elettrochimica
- Elettrolisi
Riferimenti bibliografici
FONSECA, M. R. M Chimica, 2. 1. ed. San Paolo: Attica, 2013.
SANTOS, WLP; MOL, GS Chimica dei cittadini, 3. 2. ed. San Paolo: Editora AJS, 2013.
USBERCO, J. Collegare la chimica, 2: la chimica. - 2. ed. San Paolo: Saraiva, 2014.