La cinetica chimica studia la velocità delle reazioni chimiche e i fattori che influenzano la velocità di tali reazioni.
Usa le domande qui sotto per mettere alla prova le tue conoscenze e controlla i commenti sulle risoluzioni.
domanda 1
Per quanto riguarda i fattori che influenzano la velocità di una reazione chimica, è SCORRETTO affermare che:
a) Maggiore è la concentrazione dei reagenti, più veloce è la reazione.
b) Maggiore è la superficie di contatto, maggiore è la velocità di reazione.
c) Maggiore è la pressione, più veloce è la reazione.
d) Maggiore è la temperatura, più veloce è la reazione.
e) La presenza di un catalizzatore mantiene costante la velocità di reazione.
Alternativa errata: e) La presenza di un catalizzatore mantiene costante la velocità di reazione.
I catalizzatori aumentano la velocità di reazione, poiché facilitano la formazione del complesso attivato tra i reagenti.
Con questo, i catalizzatori creano un meccanismo più breve per lo sviluppo della reazione, causando un aumento della velocità.
Domanda 2
Secondo _____________ devono verificarsi collisioni efficaci tra i reagenti per la formazione dei prodotti. Inoltre, c'è abbastanza ___________ per rompere i legami chimici dei reagenti e formare un ___________, che è uno stato intermedio prima della formazione dei prodotti.
Le parole che riempiono correttamente gli spazi vuoti sono rispettivamente:
a) entalpia, energia cinetica e variazione del catalizzatore.
b) teoria dell'urto, energia di attivazione e complesso attivato.
c) velocità di reazione, entalpia e inibitore.
d) pressione parziale, entropia e substrato.
Alternativa corretta: b) teoria dell'urto, energia di attivazione e complesso attivato.
Secondo la teoria delle collisioni, le collisioni tra i reagenti sono necessarie affinché si verifichi una reazione chimica. Per questo, le sostanze devono trovarsi in una posizione favorevole affinché gli shock siano efficaci.
L'energia di attivazione agisce come una barriera energetica che deve essere superata per rompere i legami dei composti che reagiscono. Più bassa è l'energia di attivazione, più veloce è la reazione.
Il complesso attivato è una specie intermedia instabile formata prima dei prodotti.
Domanda 3
Le seguenti quattro affermazioni sono fatte sui catalizzatori:
IO. Un catalizzatore funziona aumentando la velocità di una reazione, ma non ne modifica le prestazioni.
II. In una reazione chimica il catalizzatore non viene consumato nel percorso di reazione.
III. I catalizzatori creano un percorso alternativo per trasformare i reagenti in prodotti. Per questo è necessaria una maggiore energia di attivazione.
IV. Il catalizzatore è solo in grado di accelerare la reazione nella direzione in avanti.
Le opzioni che presentano informazioni corrette sui catalizzatori sono:
a) I e II
b) II e III
c) I e IV
d) Tutti
Alternativa corretta: a) I e II.
I catalizzatori sono usati per accelerare le reazioni chimiche. La reazione che utilizza il catalizzatore non ne modifica la resa, ovvero viene prodotta la quantità prevista di prodotto, ma in minor tempo.
I catalizzatori non vengono consumati durante la reazione chimica, aiutano nella formazione del complesso attivato. Pertanto, un catalizzatore può essere recuperato alla fine della reazione chimica.
I catalizzatori sono in grado di ridurre il tempo di reazione creando un meccanismo alternativo per la formazione di prodotti con energia di attivazione inferiore. Pertanto, la reazione avviene più velocemente.
I catalizzatori agiscono sia nella direzione in avanti che nella direzione inversa della reazione.
domanda 4
La velocità con cui avviene una reazione chimica dipende da:
IO. Numero di collisioni effettive tra i reagenti.
II. Energia sufficiente per riorganizzare gli atomi.
III. Orientamento favorevole delle molecole.
IV. Formazione di un complesso attivato.
a) I e II
b) II e IV
c) I, II e III
d) I, II, III e IV
Alternativa corretta: d) I, II, III e IV.
Le collisioni efficaci si verificano quando i reagenti sono in posizioni favorevoli agli urti, che promuoveranno il riarrangiamento degli atomi.
L'energia di attivazione deve essere sufficiente affinché la collisione tra i reagenti determini la rottura dei legami e la formazione del complesso attivato.
Non tutte le collisioni tra le particelle che reagiscono provocano la reazione. L'orientamento con cui avviene la collisione è importante per la formazione dei prodotti.
Il complesso attivato è uno stato intermedio e instabile prima della formazione dei prodotti. Viene creato quando viene superata l'energia di attivazione per la reazione.
domanda 5
L'anidride carbonica è un gas formato dalla reazione tra monossido di carbonio e gas di ossigeno, secondo l'equazione chimica sottostante.
CO(g) + ½ il2(g) → CO2(g)
Sapendo che in 5 minuti di reazione sono state consumate 2,5 moli di CO, qual è la velocità di sviluppo della reazione in funzione del consumo di O2?
a) 0,2 moli. min-1
b) 1,5 moli. min-1
c) 2,0 moli. min-1
d) 0,25 moli. min-1
Alternativa corretta: d) 0,25 mol. min-1
Per rispondere a questa domanda dobbiamo guardare l'equazione chimica.
CO(g) + ½ il2(g) → CO2(g)
Nota che 1 mole di monossido di carbonio reagisce con ½ mole di ossigeno per formare 1 mole di anidride carbonica.
La quantità indicata nella dichiarazione si riferisce al monossido di carbonio, ma la risposta deve essere in termini di ossigeno. Per questo dobbiamo eseguire una regola del tre e trovare la quantità di ossigeno.
1 mol CO - ½ mol O2
2,5 mol CO - x di O2
x = 1,25 moli
Ora applichiamo i valori nella formula per la velocità di sviluppo della reazione.
Pertanto, la velocità di sviluppo della reazione rispetto all'ossigeno è 0,25 mol.min-1.
domanda 6
Da notare la rappresentazione grafica dello sviluppo di una ipotetica reazione chimica, che mette in relazione energia e percorso di reazione.
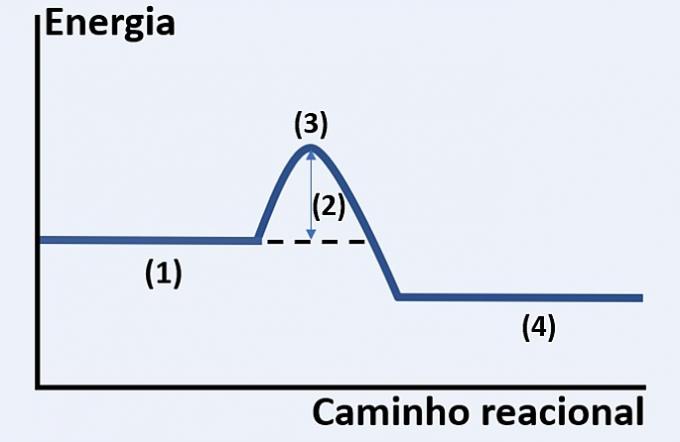
Controllare l'alternativa che sostituisce correttamente (1), (2), (3) e (4), rispettivamente.
a) substrati, calore rilasciato, stato energetico massimo e fine reazione.
b) reagenti, energia di attivazione, complesso attivato e prodotti.
c) reagenti, energia cinetica, catalizzatore e substrati.
d) reagenti, calore assorbito, energia termica e prodotti.
Alternativa corretta: b) reagenti, energia di attivazione, complesso attivato e prodotti.
Il grafico mostrato è quello di una reazione endotermica, cioè c'è assorbimento di energia perché la reazione si verifichi.
voi reagenti (1) sono all'inizio del grafico e il energia di attivazione (2) corrisponde alla differenza tra l'energia immagazzinata nei reagenti e nel complesso attivato (3). Infine, dopo aver superato lo stato intermedio, la formazione di prodotti (4).
Pertanto, i reagenti devono superare l'energia di attivazione per riorganizzare i loro atomi in una struttura intermedia chiamata complesso attivato affinché i prodotti si formino.
domanda 7
La sostanza A è in grado di decomporsi e diventare sostanza B. Osserva lo sviluppo di questa reazione nell'immagine qui sotto.

Per quanto riguarda la velocità di reazione, possiamo dire che:
a) La sostanza A si decompone tra 0 e 15 s ad una velocità di 0,35 mol.s-1.
b) La sostanza A si decompone tra 15 e 30 s ad una velocità di 0,02 mol.s-1.
c) La sostanza A si decompone tra 0 e 15 s ad una velocità di 0,04 mol.s-1.
d) La sostanza A si decompone tra 15 e 30 s ad una velocità di 0,03 mol.s-1.
Alternativa corretta: d) La sostanza A si decompone tra 15 e 30 s ad una velocità di 0,03 mol.s-1.
Il tasso di decomposizione della sostanza A può essere calcolato con la formula:
Calcoliamo la velocità di reazione in termini di sostanza A tra gli intervalli dati.
Intervallo tra 0 e 15:
Intervallo tra 15 e 30:
Pertanto, l'alternativa d è corretta, poiché la sostanza A si decompone tra 15 e 30 s ad una velocità di 0,03 mol.s.-1.
domanda 8
Considera la seguente reazione ipotetica.
aA + bB → cC + dD
Notare la variazione nella concentrazione di A e C di seguito.
| Volte) | 0 | 5 | 10 | 15 | 20 | 25 |
|---|---|---|---|---|---|---|
| Consumo di A (mol/L) | 7,5 | 6,0 | 4,5 | 3,0 | 2,5 | 1,0 |
| Formazione di C (mol/L) | 0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
Sulla base delle informazioni fornite nella domanda, qual è, rispettivamente, il tasso di consumo di A e il tasso di formazione di C nell'intervallo tra 5 e 25 min?
a) 0,3 moli. l-1.S-1 e 0,1 moli. l-1.S-1
b) - 0,1 moli. l-1.S-1 e 0,3 moli. l-1.S-1
c) - 0,25 moli. l-1.S-1 e 0,1 moli. l-1.S-1
d) 0,1 moli. l-1.S-1 e 0,3 moli. l-1.S-1
Alternativa corretta: c) - 0,25 mol. l-1.S-1 e 0,1 moli. l-1.S-1.
Un tasso di consumo:
Tasso di allenamento C:
Pertanto, nella reazione, A viene consumato ad una velocità di 0,25 mol.s-1, quindi il suo valore è negativo, mentre B si forma ad una velocità di 0,1 mol. l-1.S-1.
Leggi anche tu:
- Cinetica chimica
- termochimica
- Equilibrio chimico
- Reazioni chimiche


