L'elettrolisi è un reazione chimica non spontanea che comporta una reazione di ossidoriduzione, che è causata da una corrente elettrica.
Affinché l'elettrolisi abbia luogo, la corrente elettrica coinvolta deve essere continua e avere una tensione sufficiente.
Affinché gli ioni coinvolti abbiano libertà nel movimento che compiono, l'elettrolisi può avvenire per fusione (elettrolisi ignea) o per dissoluzione (elettrolisi in soluzione).
Applicazioni di elettrolisi
Molti materiali e composti chimici sono prodotti dal processo di elettrolisi, ad esempio:
- alluminio e rame
- idrogeno e cloro nel cilindro
- bigiotteria (processo di zincatura)
- pentola a pressione
- ruota in magnesio (coprimozzi auto).
Leggi dell'elettrolisi
Le leggi dell'elettrolisi furono sviluppate dal fisico e chimico inglese Michael de Faraday (1791-1867). Entrambe le leggi regolano gli aspetti quantitativi dell'elettrolisi.
IL prima legge dell'elettrolisi ha la seguente dichiarazione:
“La massa di un elemento, depositata durante il processo di elettrolisi, è direttamente proporzionale alla quantità di elettricità che passa attraverso la cella elettrolitica”.
Q = io. t
Dove,
Q: carica elettrica (C)
io: intensità di corrente elettrica (A)
t: intervallo di tempo di passaggio della/e corrente/e elettrica/e
IL seconda legge dell'elettrolisi ha la seguente dichiarazione:
“Le masse dei vari elementi, quando depositate durante l'elettrolisi dalla stessa quantità di elettricità, sono direttamente proporzionali ai loro equivalenti chimici”.
M = K E
Dove,
M: sostanza massa substance
K: costante di proporzionalità
E: grammo equivalente di sostanza
Scopri di più nell'articolo: La costante di Faraday.
Classificazione
Il processo di elettrolisi può avvenire per fusione o dissoluzione:
Elettrolisi Ignea
L'elettrolisi ignea è quella che viene elaborata da un elettrolita fuso, cioè mediante il processo di Fusione.
Ad esempio, usiamo NaCl (cloruro di sodio). Quando riscaldiamo la sostanza a 808 °C, si fonde e gli ioni presenti (Na+ e Cl-) iniziano ad avere maggiore libertà di movimento, allo stato liquido.
quando il corrente elettrica passa nella cella elettrolitica, i cationi Na+ sono attratti dal polo negativo, chiamato catodo. Già gli anioni di Cl-, sono attratti dal polo positivo, ovvero dall'anodo.
Nel caso di Na+ avviene una reazione di riduzione, mentre in Cl-, c'è una reazione di ossidazione.
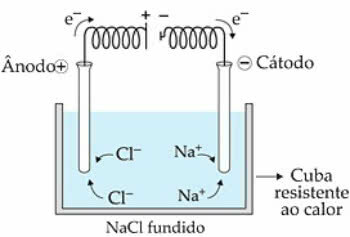
Schema di elettrolisi ignea di NaClCl
Elettrolisi acquosa
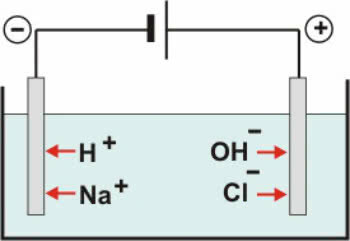
Nell'elettrolisi acquosa, il solvente ionizzante utilizzato è l'acqua. In soluzione acquosa, l'elettrolisi può essere eseguita con elettrodi invertiti o elettrodi attivi (o reattivi).
Elettrodi inerti: l'acqua nella soluzione ionizza secondo l'equazione:
H2O ↔ H+ + OH-
Con il dissociazione di NaCl abbiamo:
NaCl → Na+ + Cl-
Quindi, i cationi H+ e via+ possono essere scaricati al polo negativo, mentre gli anioni OH- e Cl- può essere scaricato al polo positivo.
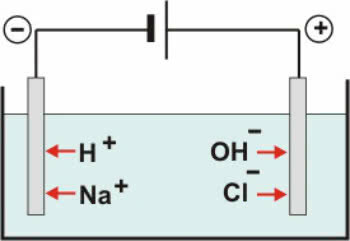
Schema di elettrolisi acquosa NaCl
Nei cationi si ha una reazione di riduzione (riduzione catodica), mentre negli anioni si ha una reazione di ossidazione (ossidazione anodica).
Quindi abbiamo la reazione di elettrolisi:
2 NaCl + 2 H2O → 2 pollici+ + 2 OH- + H2 + Cl2
Da ciò possiamo concludere che le molecole di NaOH rimangono in soluzione, mentre H2 viene rilasciato al polo negativo e il Cl2, al polo positivo.
Questo processo risulterà nell'equazione equivalente:
2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2
Elettrodi attivi: in questo caso gli elettrodi attivi partecipano all'elettrolisi, ma subiscono corrosione.
Ad esempio, abbiamo l'elettrolisi in soluzione acquosa di solfato di rame (CuSO4):
CUSO4 → Cu2 + OS 2-4
H2O → H+ + OH-
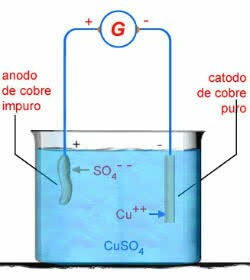 Schema di elettrolisi acquosa CuSO4
Schema di elettrolisi acquosa CuSO4
In questo caso, l'anodo di rame si corrode:
Culo0 → Cu2+ + 2e-
Questo perché, secondo i potenziali standard degli elettrodi, la corrente elettrica ha un tempo più facile rimuovendo gli elettroni dal Cu0 rispetto al sistema operativo 2-4 o da oh-.
Pertanto, al polo negativo, si verifica la seguente reazione di elettrolisi:
2e- + Cu2+ → Cu
Al polo positivo abbiamo la reazione di elettrolisi:
Cu → Cu2+ +2e-
Infine, quando aggiungiamo le due equazioni dell'elettrolisi, abbiamo come risultato zero.
Vuoi saperne di più sull'argomento? Leggi gli articoli:
- Ione, catione e anione
- Reazioni chimiche
- reazioni di ossidoriduzione
Batteria ed elettrolisi
L'elettrolisi si basa su un fenomeno inverso a quello della batteria. Nell'elettrolisi, il processo non è spontaneo, come accade nelle batterie. In altre parole, l'elettrolisi converte l'energia elettrica in energia chimica, mentre la cella genera energia elettrica dall'energia chimica.
saperne di più su Elettrochimica.
Esercizi
1. (Ulbra-RS) Il potassio metallico può essere prodotto dall'elettrolisi ignea del cloruro di potassio. Da tale affermazione, spunta l'alternativa corretta.
a) L'elettrolisi è un processo che coinvolge reazioni di ossidoriduzione e riduzione motivate dalla corrente elettrica.
b) L'elettrolisi ignea del cloruro di potassio avviene a temperatura ambiente.
c) Il potassio si trova in natura nella forma ridotta (K0).
d) La reazione di elettrolisi è quella che avviene con l'aiuto della radiazione ultravioletta.
e) Nel processo di elettrolisi del cloruro di potassio, per ottenere potassio metallico, avviene il trasferimento di elettroni dal potassio al cloro.
In alternativa a
2. (UFRGS-RS) Nel catodo di una cella di elettrolisi c'è sempre:
a) Deposizione di metalli.
b) Una semireazione di riduzione.
c) Produzione di corrente elettrica.
d) Rilascio di gas idrogeno.
e) Corrosione chimica.
Alternativa b
3. (Unifor-CE) Le seguenti proposizioni sono legate all'elettrolisi:
IO. Le reazioni di elettrolisi si verificano con il consumo di energia elettrica.
II. Le soluzioni acquose di glucosio non possono essere elettrolizzate perché non conducono corrente elettrica.
III. Nell'elettrolisi delle soluzioni saline, i cationi metallici subiscono ossidazione.
Possiamo dire che solo:
a) Ho ragione.
b) II è corretto.
c) III è corretto.
d) I e II sono corretti.
e) II e III sono corretti.
Alternativa
4. (FEI-SP) Due studenti di Chimica hanno eseguito l'elettrolisi BaCl2; il primo acquoso e il secondo focoso. Per quanto riguarda il risultato, possiamo dire che entrambi hanno ottenuto:
a) H2 è il2 agli anodi.
b) H2 e Ba agli anodi.
c) Cl2 e Ba sugli elettrodi.
d) H2 ai catodi.
e) Cl2 agli anodi.
Alternativa e
5. (Vunesp)"Piscina senza chimica” è una pubblicità che riguarda il trattamento dell'acqua. È noto, tuttavia, che il trattamento consiste nell'aggiungere all'acqua cloruro di sodio e far passare questa acqua attraverso un contenitore dotato di elettrodi di rame e platino collegati ad un cavo auto.
a) Sulla base di queste informazioni, discutere se il messaggio pubblicitario è corretto
b) Considerando gli elettrodi inerti, scrivere le equazioni delle reazioni coinvolte che giustificano la risposta precedente.
a) Il messaggio dell'annuncio non è corretto, in quanto vi sarà formazione di prodotti chimici.
b) 2 NaCl + 2H2O → 2 NaOH + H2 + Cl2 (reazione che forma cloro, utile nel trattamento dell'acqua della piscina)
2 NaOH + Cl2 → NaCl + NaClO + H2O (reazione che forma NaClO, un forte battericida)