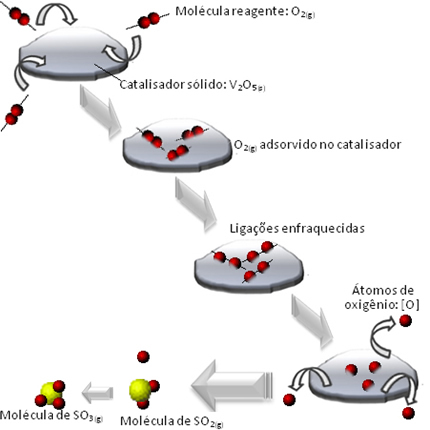
Una soluzione è una miscela omogenea di due o più sostanze.. Come, ad esempio, una soluzione di sale (soluto) disciolto in acqua (solvente).

Soprattutto nei laboratori e nelle industrie chimiche, questo processo è molto importante, perché il chimico ha bisogno di preparare soluzioni con concentrazioni note. Inoltre, nelle attività sperimentali, vengono utilizzate soluzioni con concentrazioni molto basse, per cui un campione della soluzione concentrata viene diluito alla concentrazione desiderata.
Quotidianamente, più volte, senza nemmeno rendercene conto, eseguiamo il processo di diluizione delle soluzioni. Ad esempio, la confezione dei prodotti per la pulizia e l'igiene della casa, come i disinfettanti, consiglia di diluirli prima dell'uso. Alcuni produttori suggeriscono sulle etichette dei prodotti di diluirlo con acqua in una proporzione da 1 a 3, ovvero, per ogni parte del prodotto, devono essere aggiunte 3 parti di acqua. Questo perché il prodotto è molto concentrato e forte e può danneggiare il luogo in cui verrà applicato se non viene diluito nel modo giusto. D'altra parte, se lo diluisci più del dovuto, puoi perdere denaro, perché il prodotto non raggiungerà il risultato desiderato.

Un altro esempio è quando produciamo succhi. Le etichette di molti succhi concentrati indicano che un bicchiere di succo deve essere diluito o mescolato con 5 bicchieri d'acqua. Quindi, il succo è "più debole", cioè meno concentrato.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Immagina di aver diluito un tale succo in 3 L di acqua. Se la concentrazione iniziale del succo era di 40 g/L, significa che aveva una massa di 40 g per ogni litro di solvente. Ma poiché avremo 3 L, la massa sarà divisa per 3 e la concentrazione sarà quindi di circa 13, 33 g/L o 13 grammi per ogni litro di soluzione. Tuttavia, nell'intera soluzione, rimane ancora la massa del soluto di 40 g.
Il calcolo di questa nuova concentrazione può essere effettuato come segue:
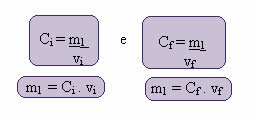
Dove gli indici i e f rappresentano, rispettivamente, i valori iniziale e finale. Poiché il valore di m1 non è cambiato, possiamo equalizzare le equazioni:
Çio. vio = Cf. vf
Sostituendo i valori che abbiamo, secondo l'esempio precedente, nota:
Soluzione iniziale:
Çio: 40 g/l
m1: 40 g
vio: 1L
Soluzione finale:
Çf: ?
m1: 40 g
vf: 3L
Çio. vio = Cf. vf
(40 g/litro). (1 L) = Cf. 3L
Çf = 40 g/l
3
Çf = 13,333 g/L
Lo stesso ragionamento vale anche per la concentrazione molare (M) e per la percentuale in massa di soluto o titolo (T):
Mio. vio = Mf. vf e Tio. vio = Tf. vf
di Jennifer Fogaça
Laureato in Chimica
Squadra scolastica brasiliana
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Diluizione delle soluzioni"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm. Consultato il 27 giugno 2021.