L'azione di un catalizzatore è fondamentalmente quella di accelerare lo sviluppo di una particolare reazione. Questo è possibile perché il catalizzatore cambia il meccanismo con cui procede la reazione, portando a un "percorso alternativo" che richiede meno energia di attivazione affinché la reazione abbia inizio e raggiunga il complesso attivato.
Esistono diversi tipi di catalisi, uno dei quali è il catalisi eterogenea, che può essere definito come quello che si verifica quando il sistema ha più di una fase, cioè i reagenti ei prodotti si trovano in uno stato fisico diverso dallo stato fisico del catalizzatore.
Un esempio che possiamo citare è uno stadio intermedio di formazione di acido solforico (H2SOLO4(ac)). Questa fase consiste nella formazione di anidride solforosa (SO3(g)) attraverso la reazione di combustione dell'anidride solforosa (SO2(g)):
2 SO2(g) + O2(g) → 2 SO3(g)
Poiché questa reazione procede così lentamente, viene utilizzato un catalizzatore per accelerarla. Un catalizzatore che può essere utilizzato in questo caso è il pentossido di divanadio (V
2oh5(S)), che è solido. Poiché i reagenti e il prodotto di reazione sono gassosi, avremo un sistema eterogeneo.Ma come può il pentossido di divanadio accelerare la reazione?
Quello che succede è che le molecole del reagente ossigeno vengono adsorbite, cioè trattenute sulla superficie del pentossido di divanadio. Questo fa sì che i legami delle molecole di questo gas si indeboliscano nel tempo, il che facilita la formazione del complesso attivato e, di conseguenza, diminuisce l'energia di attivazione della reazione, aumentando la sua velocità di sviluppo, cioè la sua velocità.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Guarda come succede nel diagramma qui sotto:
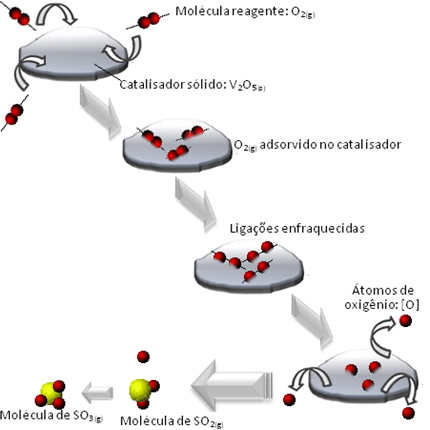
Di seguito sono riportati altri esempi di catalisi eterogenea. Si noti che in entrambi i casi i reagenti e i prodotti sono allo stato gassoso, acquoso o liquido, mentre i catalizzatori sono allo stato solido:
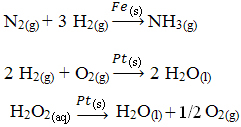
Un esempio di catalisi eterogenea che si verifica nella nostra vita quotidiana è quello dei convertitori catalizzatore per auto car, meglio noto come catalizzatori. Questi dispositivi antinquinamento sono rivestiti con sostanze che fungono da catalizzatori, essendo solitamente una lega di palladio e rodio (per motori a benzina) e palladio e molibdeno (per motori a benzina). alcol).
All'interno di questo catalizzatore avvengono reazioni chimiche in cui i gas da combustione incompleta, più dannosi per l'uomo, vengono convertiti in gas non tossici. I reagenti e i prodotti sono tutti gas, mentre i catalizzatori sono solidi.
Per saperne di più sul sistema operativo di questa apparecchiatura, leggere il testo: "Catalizzatore”.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "catalisi eterogenea"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/catalise-heterogenea.htm. Consultato il 27 giugno 2021.



