Come spiegato nel testo “Catalisi e catalizzatore”, i catalizzatori sono specie chimiche che accelerano la velocità delle reazioni. Il suo utilizzo è molto utile nelle industrie chimiche, dove si cerca di risparmiare più tempo possibile nella produzione.
Tuttavia, in certe situazioni è più interessante che la reazione proceda più lentamente; come, ad esempio, quando si vuole determinare la velocità di reazioni molto veloci. Per realizzare questa impresa, controllando e studiando queste reazioni, è consuetudine aggiungere una sostanza che rallenta le reazioni, che sono chiamate inibitori, veleni o anticatalisti.
Queste specie chimiche si combinano con il catalizzatore, annullando o diminuendo la sua azione. Ciò è possibile perché il meccanismo d'azione del catalizzatore è quello di diminuire l'energia di attivazione, facilitando il processo di reazione e aumentandone la velocità; già gli inibitori agiscono inversamente, nel senso che aumentano l'energia di attivazione necessaria affinché i reagenti raggiungano il complesso attivato.
Un esempio che si può citare è l'arsenico (As), che ha questa funzione nella reazione di Haber-Bosch, reazione largamente utilizzata nell'industria per la produzione di ammoniaca, utilizzando ferro (Fe(S)) come suo catalizzatore. Pertanto, l'efficienza del ferro diventa molto piccola in presenza di arsenico, che lo inibisce, cioè è il veleno catalizzatore di questa reazione, che è mostrato di seguito:
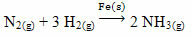
L'arsenico può anche esercitare un'azione anti-catalitica quando si utilizza platino metallico (Pt(S)) come catalizzatore per la reazione di combustione di SO SO2(g), per la produzione di anidride solforosa (SO3(g)). La presenza di arsenico, anche in piccole quantità, annulla l'azione catalitica del platino, che può paralizzare parte della produzione. Ecco perché, normalmente, nelle industrie che si occupano di questa produzione, viene utilizzato pentossido di divanadio (V2oh5(i)) come catalizzatore al posto del platino.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Un altro esempio si verifica nella seguente reazione di decomposizione del perossido di idrogeno:
2 ore2oh2(ac) → 2 ore2oh(1) + 1 O2(g)
In questo caso, un inibitore che può essere utilizzato è un acido, perché quando il mezzo è acido, la reazione procede più lentamente.
Ma l'inibitore è anche ampiamente utilizzato dall'industria, principalmente per agire come ritardante di reazione della degradazione naturale di alimenti, bevande, cosmetici e medicinali.
I cosmetici, ad esempio, possono impiegare molto tempo per raggiungere il consumatore; quindi, in essi vengono utilizzati vari conservanti, come il propilparabene, che viene utilizzato nella fase oleosa e funge da antimicotico, e il metilparabene, che viene utilizzato nella fase acquosa e che ha un effetto antisettico. Le loro rispettive strutture sono mostrate di seguito:
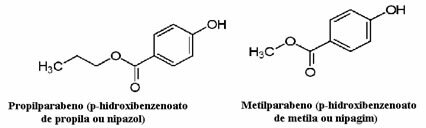
È interessante che su molte etichette di cosmetici ci sia la seguente frase: “Non contiene parabeni”. Ciò significa che questo cosmetico non ha questi conservanti di cui abbiamo parlato e che, normalmente, non sono stati testati sugli animali.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Inibitori Catalizzatori"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/inibidores-catalisador.htm. Consultato il 27 giugno 2021.


