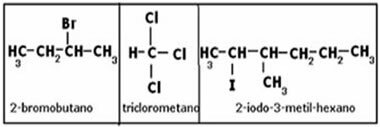
Questo testo propone consigli per il calcolo del volume parziale di un gas. Ricorda che il volume parziale di un gas è lo spazio che un gas occupa all'interno di un contenitore, quando su di esso viene esercitata tutta la pressione della miscela di gas.
oh calcolo del volume parziale di un gas può tenere conto di diverse variabili, quali:
La quantità di materia nel gas;
La quantità di materia nella miscela di gas;
La pressione totale della miscela di gas;
Il volume totale della miscela di gas;
La frazione in quantità di materia nel gas;
La temperatura della miscela di gas in Kelvin.
Ora segui il consigli per il calcolo del volume parziale di un gas, in cui utilizziamo tutte le variabili proposte sopra:
→ 1° consiglio: formule
Per calcolare il volume totale (Vt) della miscela di gas, utilizzare:
Vt = VIL + VB + VÇ + ...
Per calcolare il volume parziale di un gas da frazione in quantità di materia di gas (XIL ) e il volume totale (Vt), uso:
VIL = XIL
Vt
Per calcolare la frazione in quantità di materia nel gas (XIL), usiamo la relazione tra la quantità di materia nel gas (nIL) e la miscela (nt):
XIL = noIL
nt
Per calcolare il volume parziale di un gas dalle quantità di materia nel gas e nella miscela (nt), uso:
VIL= noIL
Vt not
Per calcolare la quantità di materia in un gas basta dividere la massa per il suo massa molare (calcolato utilizzando la formula molecolare della sostanza):
noIL = mIL
MIL
Per calcolare la quantità di materia totale (nt) della miscela, dobbiamo aggiungere le quantità di materia di tutti i gas:
not = nIL + nB + nÇ + ...
Formula relativa alla pressione parziale (PIL ) e il volume parziale (VIL ) di un gas:
PIL= VIL
Pt Vt
→ 2° consiglio
Quando l'esercizio richiede il calcolo del volume parziale, ma fornisce le pressioni parziali dei gas della miscela:
Un elemento chiave che l'esercizio fornirà, oltre alle pressioni parziali, è il volume del sistema;
Le pressioni parziali fornite devono essere aggiunte per trovare la pressione totale dell'impianto (Pt):
Pt =PIL + PB + PÇ
Per determinare il volume parziale di ciascun gas nella miscela è sufficiente utilizzare la seguente espressione:
PIL= VIL
Pt Vt
Esempio:Una miscela è formata dai gas CO, O2 e così2, in un contenitore il cui volume è 5L. Ciascun gas contenuto nel contenitore ha la seguente pressione parziale, rispettivamente: 0,50 atm, 0,20 atm e 0,30 atm. Calcolare i volumi parziali per ciascuno dei componenti di questa miscela di gas.
1° passo: Aggiungere le pressioni parziali (0,50 atm, 0,20 atm e 0,30 atm) dei tre gas forniti (CO, O2 e così2):
Pt =PCO + PO2 + PSO2
Pt = 0,5 + 0,2 + 0,3
Pt = 1 atm
2° passo: Calcolare il volume parziale di CO utilizzando il volume totale (5L), la sua pressione parziale (0,5 atm) e la pressione totale (1 atm) nell'espressione:
PCO = VCO
Pt Vt
0,5 = VCO
15
1.VCO = 0,5.5
VCO = 2,5 L
3° Passo: Calcola il volume parziale dell'O2 usando il volume totale (5L), la sua pressione parziale (0,2 atm) e la pressione totale (1 atm) nell'espressione:
PO2= VO2
Pt Vt
0,2 = VO2
1 5
1.VO2 = 0,2.5
VO2 = 1 L
Passaggio 4: Calcola il volume parziale del sistema operativo2 usando il volume totale (5L), la sua pressione parziale (0,2 atm) e la pressione totale (1 atm) nell'espressione:
PSO2= VSO2
Pt Vt
0,3 = VSO2
1 5
1.VSO2 = 0,3.5
VSO2 = 1,5 L
→ 3° consiglio
Calcolo del volume parziale di un gas mediante percentuali molari:
In questo tipo di situazione, l'esercizio fornisce la pressione totale, le percentuali molari dei gas e il volume totale del sistema;
-
Le percentuali molari date sono le frazioni in quantità di materia di ciascun gas. Per usarli nei calcoli basta dividere per 100;
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
La formula indicata per determinare il volume parziale di gas è la seguente:
VIL = XIL
Vt
Esempio: L'aria è una miscela di gas. Più del 78% di questa miscela è azoto. L'ossigeno rappresenta circa il 21%. Argon, 0,9% e anidride carbonica, 0,03%. Il resto è costituito da altri gas. Il volume occupato dall'ossigeno in questa miscela, in un ambiente da 10 L, è pari a?
1° passo: trasformare la percentuale di ossigeno gassoso (O2) in frazione molare dividendo il valore dato per 100:
XO2 = 21
100
XO2 = 0,21
2° passo: utilizzare il volume totale (33.6L) e la frazione in quantità di materia dell'O2 (0.21) nell'espressione:
VO2 = XO2
Vt
VO2 = 0,21
10
VO2 = 10. 0,21
VO2 = 2,1 L
→ 4° consiglio
Quando l'esercizio informa i volumi, le temperature e le pressioni di ciascun gas, allora dice che sono stati miscelati e iniziano a esercitare una nuova pressione.
In questo caso abbiamo il volume, la pressione e la temperatura di ogni gas singolarmente;
L'esercizio informerà la pressione che la miscela di questi gas esercita a una nuova temperatura;
Calcola il numero di moli di ciascun gas (nIL) attraverso la sua pressione, volume e temperatura (in Kelvin) nell'espressione di Clapeyron:
PIL.VIL = nIL.R.T
Dopo aver calcolato il numero di moli di ciascun gas, è necessario sommarli per determinare il numero di moli totale (nt):
not = nIL + nB + ...
Con il numero di moli, dobbiamo determinare il volume totale attraverso la pressione totale del contenitore e la temperatura, anche nell'equazione di Clapeyron
Pt.Vt = nt.R.T
Alla fine avremo dati sufficienti per calcolare il volume parziale di ciascun gas (VIL) attraverso il suo numero molare (nIL), numero totale di moli e volume totale nell'espressione seguente:
VIL = noIL
Vt not
Esempio:Un volume di 8,2 L di idrogeno gassoso a 227°C, esercitando una pressione di 5 atm, e un volume di 16,4 L di azoto gassoso, a 27°C e 6 atm, vengono trasferiti in un altro recipiente mantenuto a temperatura costante di -73°C. Sapendo che la miscela ora esercita una pressione di 2 atm, calcolare il volume del contenitore ei volumi parziali di ciascun gas. Dato: R=0.082 atm. Talpa-1.K-1
1° passo: calcolare il numero di moli di ciascun gas utilizzando volume, temperatura (in Kelvin; basta aggiungere il valore dato a 273) e pressione:
Per gas idrogeno (H2)
PH2.VH2 = nH2RT
5.8.2 = nH2.0,082.500
41 = nH2.41
noH2 = 41
41
noH2 = 1 mol
Per azoto (N2)
PN2.VN2 = nN2RT
6.16.4 = nN2.0,082.300
98,4 = nN2.24,6
noN2 = 98,4
24,6
noN2 = 4 moli
2° passo: Determinare il numero di moli totale utilizzando i numeri di moli dei gas trovati nel passaggio 1:
not = nH2 + nN2
not = 1 + 4
not = 5 moli
3° Passo: Calcolare il volume del contenitore dove è stata effettuata la miscelazione. Per questo, utilizzeremo la somma dei numeri moli dei gas trovati nei passaggi 1 e 2, la pressione totale fornita e la temperatura (-73 ohC, che, in Kelvin, è 200) nell'espressione seguente:
PVt = nt.R.T
2.Vt = 5.0,082.200
2.Vt = 82
Vt = 82
2
Vt = 41 L
Passaggio 4: Calcola il volume parziale di ciascun gas utilizzando il volume totale, il numero di moli di ciascun gas e il numero di moli totali:
Per gas idrogeno:
VH2= noH2
Vt not
VH2 = 1
41.5
5. VH2 = 41.1
5.VH2 = 41
VH2 = 41
5
VH2 = 8,2 L
Per azoto:
VN2= noN2
Vt not
VN2= 4
41 5
5. VN2 = 41.4
5.VN2 = 164
VN 2 = 164
5
VN2 = 32,8 L
Di Me. Diogo Lopes Dias
Cosa sono i gas, quali sono le proprietà dei gas, composti molecolari, comprimibilità, volume fisso, energia cinetica media, temperatura assoluta di un gas, gas ideale, gas reali, gas perfetto, variabili di stato del gas, volume di un gas, le stagioni