Prima di introdurre il concetto di massa molare e numero di moli, diamo un'occhiata ad alcune definizioni importanti in questo contesto:
→ Termine molare
Molare deriva dalla parola molecola, ma cos'è esattamente una molecola? È l'insieme di atomi che sono collegati attraverso legami chimici.
→ Massa molecolare (MM)
È possibile calcolare la massa di una molecola dalla somma delle masse atomiche di ciascun atomo che compone la rispettiva molecola. Il risultato è chiamato Massa Molecolare (MM).
Quale sarebbe la massa molecolare dell'idrogeno solforato (H2S) per esempio?
Per prima cosa devi sapere cosa massa atomica di ogni atomo, che è dato dalla tavola periodica di elementi.
Massa atomica dell'idrogeno (H) = 1 a.m.u. (unità per massa atomica)
Massa atomica di zolfo (S) = 32,1 a.u.u.
La massa molecolare è la somma delle masse atomiche degli atomi.
Nota: l'idrogeno della molecola H2S ha un coefficiente di 2, quindi devi moltiplicare la sua massa per 2. Calcolo:
Massa molecolare di H2S = 1 • 2 + 32,1 = 34,1 u
(H) + (S) = (H)2S)
Massa molare e numero di moli
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
La massa molare, così come il numero di moli, è correlata alla La costante di Avogadro (6,02 x 1023) attraverso il seguente concetto:
''Il numero di entità elementari contenute in 1 mole corrisponde alla costante di Avogadro, il cui valore è 6,02 x 1023 mole-1.''
Pertanto, la massa molare è la massa di 6,02 x 1023 entità chimiche ed è espresso in g/mol.
Mappa Mentale - Mol
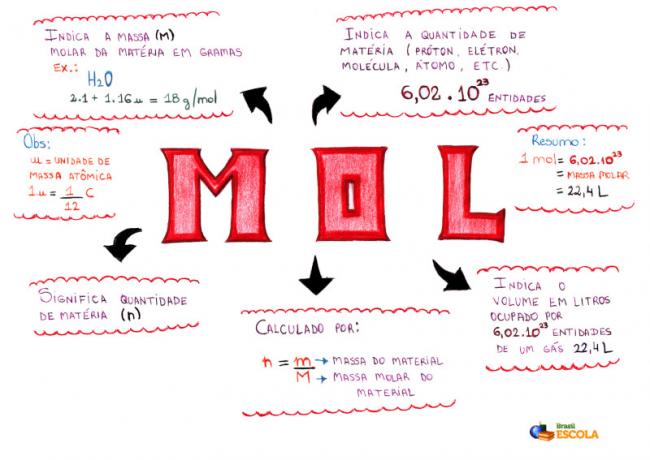
* Per scaricare la mappa mentale, Clicca qui!
Esempio: H2S
Massa molecolare = 34,1 u
Massa molare (M) = 34,1 g/mol
Ciò significa che, a 34,1 g/mol di idrogeno solforato, abbiamo 6,02 x 1023 molecole o 1 mole di molecole di idrogeno solforato.
Conclusione
Massa molecolare e massa molare hanno gli stessi valori, ciò che differisce è l'unità di misura. La massa molare è correlata al numero di moli che è dato dalla costante di Avogadro.
* Mappa mentale di Me. Diogo Lopes
di Liria Alves
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
SOUZA, Liria Alves de. "Massa molare e numero di moli"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/massa-molar-numero-mol.htm. Consultato il 27 giugno 2021.


