oh calcolo del numero di particelle atomiche è usato per indicare la quantità di protoni (nel nucleo), elettroni (nell'elettrosfera) e neutroni (nel nucleo) presenti in qualsiasi atomo o ione. Per fare ciò, è essenziale conoscere alcune caratteristiche degli atomi:
1- Numero atomico (Z)
È un codice matematico, rappresentato dalla lettera Z maiuscola, posizionato nella parte inferiore sinistra dell'abbreviazione di un atomo:
ZX
Indica il numero di protoni (p) nel nucleo e il numero di elettroni (e) nell'elettrosfera di un atomo. Quindi, in termini generali:
Z = p = e
2- Numero di massa (A)
È un codice matematico che corrisponde alla somma del numero di protoni (p) e neutroni (n), entrambi presenti nel nucleo di qualsiasi atomo. L'equazione che rappresenta il numero di massa è data da:
A = p + n
Poiché il numero di protoni è uguale al numero atomico, possiamo scrivere l'equazione per calcolare il numero di massa come segue:
A = Z + n
Se conosciamo il numero di massa e il numero atomico di un atomo, possiamo determinare il numero di neutroni come segue:
n = A - Z
3- ioni
Sono atomi che perdono o acquistano elettroni. Hanno un segno positivo o negativo posizionato in alto a destra della loro rappresentazione, come nel seguente modello:
X+ o X-
Ione positivo: questo è chiamato catione e il segno positivo indica che ha perso elettroni.
Ione negativo: questo è chiamato anione e il segno negativo indica che ha guadagnato elettroni.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
4- Somiglianze atomiche
a) Isotopi
Atomi che hanno lo stesso numero atomico e diversi numeri di massa. Esempio:
7X14 e 7sì16
Gli atomi X e Y hanno lo stesso numero atomico (a sinistra dell'acronimo), cioè uguale a 7. L'atomo X ha un numero di massa (a destra dell'acronimo) pari a 14 e l'atomo Y ha un numero di massa pari a 16.
b) isobare
Atomi che hanno lo stesso numero di massa e diversi numeri atomici. Esempio:
15X31 e 13sì31
Gli atomi X e Y hanno un numero di massa (a destra dell'acronimo) pari a 31. L'atomo X, invece, ha un numero atomico pari a 15 e l'atomo Y ha un numero atomico pari a 13.
c) Isotoni
Atomi che hanno numeri di massa e numeri atomici diversi, ma lo stesso numero di neutroni.
d) Isoelettronica
Atomi che hanno lo stesso numero di elettroni. Esempio:
12X+2 e 7sì-3
L'atomo X ha numero atomico pari a 12 ed è un catione (con carica positiva +2), quindi perde due elettroni, avendo così 10 elettroni nella sua elettrosfera. L'atomo Y, invece, ha numero atomico pari a 7 ed è un anione (con carica negativa -3), quindi guadagna tre elettroni, avendo così 10 elettroni nella sua elettrosfera.
Mappa mentale: particelle atomiche
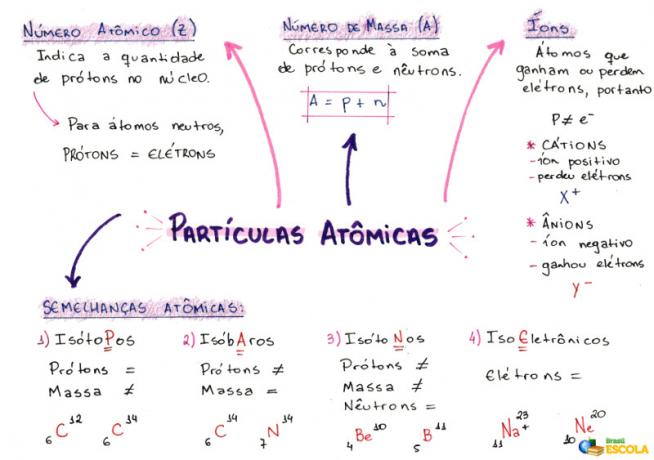
* Per scaricare la mappa mentale in PDF, Clicca qui!
Esempi di calcolo del numero di particelle atomiche
Esempio 1: Determinare il numero di protoni, neutroni ed elettroni nell'atomo 14X29.
Sono stati dati i seguenti valori per l'atomo X:
Numero di massa (in alto a destra) = 29
Numero atomico (in basso a sinistra) = 14
Per determinare il numero di protoni:
Il numero di protoni è sempre uguale al numero atomico, quindi l'atomo X ha 14 protoni.
Per determinare il numero di elettroni:
Poiché l'atomo X non è uno ione, quindi, il numero di elettroni è uguale al numero di protoni, cioè 14.
Per determinare il numero di neutroni:
Il numero di neutroni viene determinato utilizzando il numero di massa e protoni nella seguente formula:
A = p + n
29 = 14 + n
29 - 14 = n
n = 15
Esempio 2: Determinare il numero di protoni, neutroni ed elettroni dello ione X+3, sapendo che il loro numero di massa e numero atomico sono, rispettivamente, 51 e 23.
Sono stati dati i seguenti valori per lo ione X:
Numero di massa = 51
Numero atomico (in basso a sinistra) = 23
Per determinare il numero di protoni:
Il numero di protoni è sempre uguale al numero atomico, quindi l'atomo X ha 23 protoni.
Per determinare il numero di elettroni:
Lo ione X è positivo (+3), quindi è un catione che ha perso tre elettroni. Quindi il suo numero di elettroni è 20.
NOTA: La riduzione o l'aumento del numero di elettroni avviene sempre in relazione al numero atomico.
Per determinare il numero di neutroni:
Il numero di neutroni viene determinato utilizzando il numero di massa e protoni nella seguente formula:
A = p + n
51 = 23 + n
51 - 23 = n
n = 28
Esempio 3: Un atomo W ha numero atomico e massa pari rispettivamente a 29 e 57, essendo isobare di a atomo Y, che ha numero atomico pari a 30, che è isotopo di un atomo B, il cui numero di massa è 65. Con queste informazioni, determina il numero di protoni, neutroni ed elettroni nell'atomo B.
Dati forniti dall'esercizio:
Atomo W
numero atomico (in basso a sinistra) = 29
numero di massa (in alto a destra) = 57
Y isobar, cioè anche la massa di Y è 57.
Y atomo
numero atomico = 30
numero di massa = 57
Con questi due valori, dobbiamo determinare il suo numero di neutroni perché è isotono dell'elemento B:
A = Z + n
57 = 30 + n
57 - 30 = n
n = 27
Atomo B:
numero di massa = 65
numero di neutroni = 27
Con questi dati, dobbiamo determinare il suo numero atomico, perché con quello, determineremo il suo numero di protoni e il suo numero di elettroni (poiché non è uno ione):
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
Pertanto, l'atomo B ha 38 protoni, 38 elettroni e 27 neutroni.
* Mappa mentale di Victor Ricardo Ferreira
Insegnante di chimica
Di Me. Diogo Lopes Dias