Radioattività è la proprietà che alcuni atomi, come uranio e Radio, devo emettere spontaneamente energia a forma di particelle e onda, diventando elementi chimici più stabile e leggero.
tipi
La radioattività si presenta con due strade diverse radiazioni: particella — alfa (α) e beta (β); e onde elettromagnetiche — raggi gamma (γ).
raggi alfa: sono particelle positive composte da due protoni e due neutroni e con basso potere di penetrazione.
raggi beta: sono particelle negative che non contengono massa costituita da un elettrone (massa trascurabile), e il loro potere di penetrazione è maggiore di quello dei raggi alfa, ma inferiore a quello dei raggi gamma.
Gamma: sono onde elettromagnetiche ad alta energia e, non essendo particelle, non hanno massa.
Leggi anche tu: Formule di radioattività
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
legislazione
L'emissione radioattiva di particelle segue determinati comportamenti che sono spiegati dalle leggi di radioattività (una per la particella alfa e una per la particella beta), che furono descritte dal chimico inglese
Federico Soddye dal chimico e fisico polacco Kazimierz Fajans.Prima legge della radioattività
Secondo questa legge, quando un atomo radioattivo emette radiazioni di tipo alfa, darà origine a a nuovo atomo con nucleo contenente due protoni e due neutroni meno, sommando una massa quattro unità più piccole. Possiamo rappresentare la prima legge della radioattività con la seguente equazione generica:
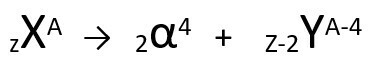
Equazione generica della prima legge della radioattività.
Vediamo un esempio:
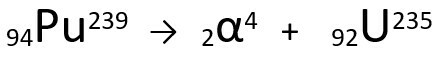
Equazione che rappresenta l'emissione di particelle α da parte del Plutonio-239.
Si noti che, quando emette una radiazione alfa, l'atomo appena formato, l'uranio-235, ha un numero di massa di quattro unità più piccolo e il numero atomico due unità più piccolo - esattamente i valori corrispondenti alla particella α emessa dal nucleo del plutonio. Per saperne di più vai su: Prima legge della radioattività o prima legge di Soddy.
Seconda legge della radioattività
La seconda legge parla di problema beta. Quando un atomo emette una particella beta, costituita da un elettrone e di massa trascurabile, la sua massa atomica resti invariato è tuo il numero atomico aumenta di un'unità. In generale, rappresentiamo come segue:
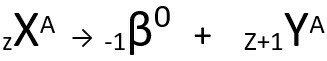
Equazione generica della seconda legge della radioattività.
Vedi l'esempio:
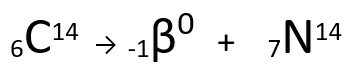
Equazione che rappresenta l'emissione di particelle da Carbon-14.
Si può vedere che l'atomo di azoto formato ha la stessa massa dell'atomo C-14, cioè sono isobare, e il suo numero atomico aumenta di un'unità. L'aumento di numero atomicoè stato spiegato dallo scienziato Henrico Fermi, che ha proposto che uno dei neutroni del nucleo subisce una trasmutazione, secondo la seguente equazione, generando unelettrone(la particella beta emessa), un neutrino(una particella subatomica senza carica elettrica e senza massa, ) e un protone(P).
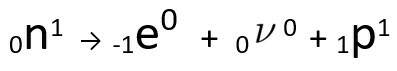
Equazione che rappresenta la trasmutazione del neutrone, secondo l'ipotesi di Fermi.
oh elettrone è il neutrino sono rilasciati a fuori dal nucleo, rimanente solo il protone, che spiega l'aumento del numero atomico Per saperne di più, vai su: Seconda Legge della Radioattività o Seconda Legge di Soddy.
Leggi anche: Differenza tra contaminazione radioattiva e irradiazione
applicazioni
nonostante il vista negativa quel deposito sulla radioattività, ha applicazioni importanti nella nostra vita quotidiana, per esempio, nel produzione di elettricitànel centrali elettriche nucleari attraverso fissionedi atomi radioattivi.
Attualmente, il Brasile non utilizza il energia nucleare come principale fonte di energia, ma dispone di centrali nucleari (Angra 1 e 2) che lavorano per fornire elettricità al Paese. Possiamo anche citare il datazione materiale trovato dagli archeologi usando carbonio-14.

Centrale nucleare di Rio de Janeiro, Brasile
Un altro ruolo fondamentale che ha la radioattività è legato all'area della medicina, come negli esami di examination Raggi Xe nel Scansioni TC, e anche in alcuni tipi di trattamento per il cancro.
Leggi anche tu: Principali rischi della produzione di energia nucleare per l'ambiente
radioattività naturale
ogni giorno siamo esposto Il piccole quantità di radiazioni, artificiali o naturali. La radioattività naturale si verifica spontaneamente in natura. Parte di questa radiazione che riceviamo proviene dal cibo consumato quotidianamente, come il Radon-226 e il Potassio-40, che sono presentati in livelli molto bassi e non mettono a rischio la nostra salute né danneggiano i valori nutrizionali degli alimenti.
Questo processo di esposizione del cibo alle emissioni radioattive ha lo scopo di conservare il cibo e promuovere a crescita delle piante. Alcuni esempi di alimenti che emettono radiazioni sono: Noci brasiliane, Banana, fagioli, carne rossa, tra gli altri.
Scoperta
Lo studio della radioattività è iniziato con la ricerca del fisico tedesco Wilhelm Röentgen, nel 1895, quando stava indagando sul effetto diluminescenza. Un altro importante scienziato per lo sviluppo della radioattività fu il fisico francese Antoine-Henri Becquerel, che notò, nel 1896, segni fatti su pellicola fotografica da un campione di sale di uranio.
Tuttavia, è stato il coppia curie che ha usato per la prima volta il termine radioattività. Nel 1898, il polacco Marie Curie proseguì gli studi sulla radioattività e fece scoperte preziose per la zona, come la scoperta di due nuovi elementi radioattivi: il polonio (Po) e il radio (Ra).
posteriormente, Ernest Rutherford scoperto la radiazione di tipo alfa (α) e beta (β), che ha consentito migliori spiegazioni per il suo modello atomico, nonché l'avanzamento della ricerca relativa alla radioattività.
Leggi anche:Marie Curie: biografia, contributi ed eredità
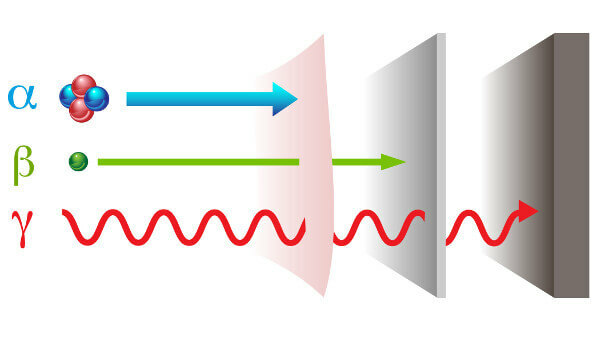
Tipi di radiazioni e loro poteri di penetrazione.
decadimento
oh decadimento radioattivo (o trasmutazione) è il processo naturale dove uno? nucleo instabile emette radiazioni, successivamente, in modo da abbassa la tua energia e diventare stabile.
Ciò si verifica normalmente con atomi di numero atomico. maggiore di 84, che sono atomi con elevata instabilità nucleare a causa della quantità di carica positiva (protoni) accumulata nel nucleo. In questo processo, il i neutroni non bastano per stabilizzare tutti i protoni raggruppati nel nucleo, e quindi il nucleo inizia a subire un decadimento radioattivo fino a quando il suo numero atomico è inferiore a 84.
In alcuni casi può capitare che atomi con numero atomico inferiore a 84 abbiano nuclei instabili e anche attraversano il processo di decadimento, ma per questo devono avere un numero di protoni ben al di sopra del numero di neutroni.
Il decadimento radioattivo è calcolato per emivita (o periodo di semi-disintegrazione, P) del radioisotopo, che è il tempo necessario affinché metà della massa del campione radioattivo iniziale si disintegra, cioè, per diventare stabile. Graficamente parlando, il concetto di emivita è rappresentato di seguito. Perché è un processo continuo, la curva tende a raggiungere zero.
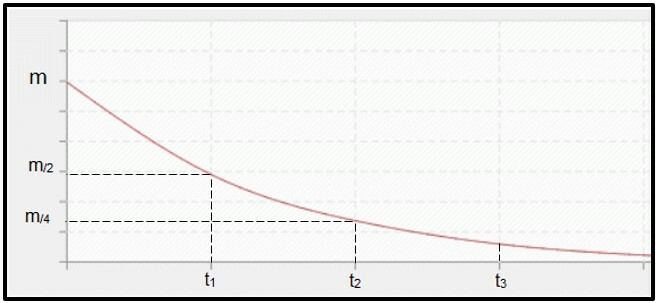
Grafico che rappresenta il tempo di dimezzamento.
I calcoli che coinvolgono il decadimento radioattivo seguono le seguenti formule:
Formula per calcolare la massa rimanente dopo l'emivita:
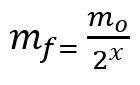
mf – massa finale
moh – massa iniziale
x – quantità di emivite trascorse
Formula per calcolare il tempo di disintegrazione di un campione radioattivo:
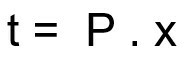
t – tempo di disintegrazione
P - periodo di emivita
x – quantità di emivite trascorse
elementi radioattivi
Ci sono due tipi di elementi radioattivi: voi naturale e il artificiale. Quelle naturali hanno elementi che si trovano in natura, già con i loro nuclei instabili, come il uranio, O attinio è il Radio. Quelli artificiali sono prodotti da processi che destabilizzano il nucleo di un atomo. In questo caso possiamo citare il astato è il francio.
I principali elementi radioattivi sono: uranio-235, cobalto-60, stronzio-90, radio-224 e iodio-131. A causa del suo ampio uso nelle centrali nucleari e nei trattamenti contro il cancro, questi elementi tendono ad apparire più frequentemente nella nostra vita quotidiana. Per saperne di più su questo argomento, vai su: elementi radioattivi.
Rifiuti radioattivi
Rifiuti radioattivi o scorie nucleari è il residuo del industrie che utilizzano materiale radioattivo nei loro processi che non hanno più applicazione pratica. Questa spazzatura viene principalmente dal comes centrali elettriche nucleari viene da applicazioni mediche.
La grande produzione di scorie radioattive è stata a problema ambientale per il mondo intero, a causa della scarsità e dell'inadeguatezza condizioni di smaltimento e deposito.
Questi sterili sono associati alla contaminazione del suolo, dei corsi d'acqua e dell'aria, con conseguente distruzione dell'ambiente gradualmente. Inoltre, comportano anche rischi per la salute umana, come ad esempio infezioni, cancro e, nei casi più gravi di contaminazione, possono portare a Morte.
esercizi risolti
(PUC-Camp-SP) La bomba atomica, chiamata anche bomba nucleare, ha atomi di uranio-235 come costituente fissile, , emettitori di particelle alfa
, emettitori di particelle alfa 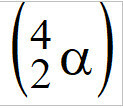 . Ogni atomo di U-235, quando emette una particella alfa, si trasforma in un altro elemento, il cui numero atomico è uguale a
. Ogni atomo di U-235, quando emette una particella alfa, si trasforma in un altro elemento, il cui numero atomico è uguale a
a) 231.
b) 233.
c) 234.
d) 88.
e) 90.
Modello: Quando un atomo emette una particella alfa si ha una diminuzione di due unità nel numero atomico, secondo la prima legge della radioattività. Quindi: 92-2 = 90. lettera e.
(PUC-Camp-SP) Lo iodio-125, una varietà radioattiva di iodio con applicazioni medicinali, ha un'emivita di 60 giorni. Quanti grammi di Iodio-125 rimarranno dopo sei mesi, sulla base di un campione contenente 2,00 g del radioisotopo?
a) 1.50
b) 0,75
c) 0,66
d) 0,25
e) 0.10
Modello: Innanzitutto, viene calcolato il numero di emivite trascorse durante i 180 giorni:
t = P X
180 = 60. X
x = 3
Una volta trovato il numero di emivite trascorse, si calcola la massa che rimarrà al termine dei 180 giorni:
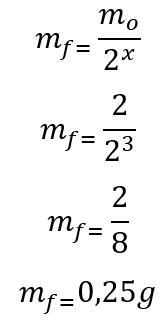
Pertanto, alla fine dei sei mesi rimarranno 0,25 g del radioisotopo di Iodio-135. Lettera D.
di Victor Felix
Laureato in Chimica