A unità di misura sono rappresentazioni di grandezze fisiche utilizzate in diversi ambiti del sapere per quantificare una materia, una sensazione, il tempo o la grandezza di qualcosa, ad esempio.
In tutto il mondo, le unità di misura seguono uno schema determinato dal Sistema internazionale di unità (SI). Dall'unità standard stabilita dal Sistema Internazionale, possiamo utilizzare anche altre unità da essa derivate, che ci consentono di confrontare ed espandere la nozione quantitativa di quantità.
Il Sistema Internazionale adotta l'unità kelvin, ad esempio, come standard per la quantità di temperatura. Questa unità è ampiamente utilizzata negli esperimenti di laboratorio, ma nella vita di tutti i giorni la maggior parte dei paesi usa l'unità gradi Celsius, che deriva dall'unità kelvin.
Leggi anche: Grandezze vettoriali e scalari
unità di massa
Le unità più utilizzate per lavorare con la massa di una materia sono:
Tonnellata (t);
Chilogrammo (kg) [unità standard di massa secondo SI];
Grammo (g);
Milligrammo (mg).
Per convertire un'unità in un'altra, segui queste relazioni:
1 t = 1000 kg
1 kg = 1000 g
1 g = 1000 mg
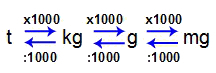
Relazione tra unità di massa
Come possiamo vedere, un'unità di massa è sempre 1000 volte maggiore dell'altra. Vedi alcuni esempi:
→ Conversione di unità di massa
Esempio 1: trasformiamo 2,5 kg in grammi.
Poiché 1 kg equivale a 1000 grammi, possiamo impostare la seguente regola del tre:
1 kg 1000 g
2,5 kg x
X. 1 = 2,5.1000
x = 2500 g
Esempio 2: trasformiamo 4 mg in kg.
Poiché 1 kg equivale a 1000000 di mg (risultato della moltiplicazione di 1000 x1000 della differenza tra l'unità kg e mg), possiamo impostare la seguente regola del tre:
1 kg 1000000 mg
x 4 mg
1000000.x = 4.1
x = 4
10000000
x = 0.000004 kg
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
unità di volume
metro cubo (m3) [unità standard di volume secondo SI];
Litro (L) o decimetro cubo (dm3);
Millilitro (mL) o centimetro cubo (cm3).
Per convertire un'unità in un'altra, segui queste relazioni:
1 m3 = 1000 L
1L = 1 dm3
1L = 1000 ml
1dm3 = 1000 cm3
1 cm3 = 1 ml

Relazione tra unità di volume
Come possiamo vedere nel diagramma sopra, un'unità di volume è sempre 1000 volte più grande dell'altra. Quando confrontiamo l'unità più grande (m3) con l'unità più piccola (mL o cm3), la differenza è 1.000.000 di volte.
→ Conversione di unità di volume
Esempio 1: trasformiamo 4.5 m3 in dm3.
come 1 m3 equivale a 1000 dm3, possiamo impostare la seguente regola del tre:
1 m3 1000 dm3
4,5 m3 X
x.1 = 4.5.1000
x = 4500 dm3
Esempio 2: trasformiamo 300 cm3 in l.
Poiché 1 L equivale a 1000 cm3, possiamo impostare la seguente regola del tre:
1L 1000 cm3
x 300 cm3
1000.x = 300.1
x = 300
1000
x = 0,3 dm3
unità di pressione
Le unità più utilizzate per lavorare con il pressione sono:
Atmosfera (atm);
Millimetro di mercurio (mmHg);
Centimetro di mercurio (cmHg);
Pascal (Pa) o kilopascal (KPa = 1000 Pa) [unità di pressione standard secondo SI].
Per convertire un'unità in un'altra, segui queste relazioni:
1 atm = 101,325 kPa
1 atm = 101325 Pa
1 atm = 760 mmHg
1 atm = 76 cmHg
NOTA: Sono state utilizzate relazioni a partire da atm perché i valori utilizzati sono numericamente più semplici da lavorare e/o memorizzare (se necessario).
→ Conversione delle unità di pressione
Esempio 1: trasformiamo 2 atm in KPa.
Poiché 1 atm equivale a 101,325 KPa, è sufficiente impostare la seguente regola del tre:
1atm 101,325 KPa
2 atm x
x.1 = 2,101,325
x = 202, 650 KPa
Esempio 2: trasformiamo 200 mmHg in cmHg.
Usando le relazioni sopra riportate, dobbiamo inizialmente convertire 200 mmHg in atm usando la seguente regola del tre:
1 atmosfera 760 mmHg
x 200 mmHg
x.760 = 200.1
x = 200
760
x = 0,26 atm
Trasformiamo quindi il risultato in atm in cmHg nella seguente regola del tre:
1 atm 76 cmHg
0,26 atm y
y.1 = 0.26.76
y = 19,76 cmHg
Esempio 3: trasformiamo 500 cmHg in KPa.
Usando le relazioni sopra riportate, dobbiamo inizialmente convertire 500 cmHg in atm usando la seguente regola del tre:
1 atm 76 cmHg
x 500 cmHg
x.76 = 500.1
x = 500
76
x = 6,57 atm
Trasformiamo quindi il risultato in atm in cmHg nella seguente regola del tre:
1 atm 101,325 KPa
6,57 atm sì
y.1 = 6,57,101,325
y = 665,70 KPa
Vedi anche:Cos'è la pressione atmosferica?
unità di temperatura
Le unità più utilizzate per lavorare con temperatura sono:
Gradi Celsius (oh);
gradi Fahrenheit (ohF);
Kelvin (K) [unità di temperatura standard secondo SI].
Per convertire un'unità di temperatura in un'altra, possiamo utilizzare le seguenti formule:
Da gradi Celsius a Kelvin: TK = TohDo + 273
Da gradi Celsius a Fahrenheit: TohÇ = TohF-32
5 9
→ Conversione delle unità di temperatura
Esempio 1: trasformiamo 45 ohC per ohf.
Per eseguire la trasformazione basta inserire i dati nella formula sottostante:
TohÇ = TohF-32
5 9
45 = TohF-32
5 9
5.(TohF-32) = 45,9
5TohF - 160 = 405
5TohF = 405 + 160
TohF = 565
5
TohF = 113 ohF
Esempio 2: trasformiamo 200K in oh.
Per eseguire la trasformazione basta inserire i dati nella seguente formula:
TK = TohDo + 273
200 = TohDo + 273
TohC = 200 - 273
TohC = - 73 ohÇ
Per saperne di più sulla conversione dei valori tra le scale termometriche, leggi il seguente testo: Conversione tra scale termometriche.
unità di lunghezza
Le unità più utilizzate per lavorare con lunghezza sono:
Chilometro (km);
Metropolitana (m) [unità standard di lunghezza secondo SI];
Centimetro (cm);
Decimetro (dm);
Millimetro (mm).
Per convertire un'unità in un'altra, segui queste relazioni:
1 km = 1000 m
1 m = 100 cm
1 dm = 10 cm
1 cm = 10 mm
→ Conversione di unità di lunghezza
Esempio 1: trasformiamo 5 km in dm.
Analizzando il diagramma, la differenza tra km e dm è dell'ordine di 100000, quindi basta impostare la seguente regola del tre:
1 km 100000 dm
5 km x
x.1 = 5.1 milioni
x = 500000 dm
Esempio 2: trasformiamo 500 mm in cm.
Poiché 1 cm equivale a 10 mm, basta usare la seguente regola del tre:
1 cm 10 mm
x 500 mm
x.10 = 500.1
x = 500
10
x = 50 cm
Unità di energia sotto forma di calore
Le unità più utilizzate per lavorare con l'energia sotto forma di calore sono:
Joule (J) o kilojoule (KJ = 1000 J) [joule è l'unità standard stabilita dal SI];
Calorie (calce) o chilocalorie (Kcal = 1000cal).
Per convertire un'unità in un'altra, segui questo elenco:
1 cal = 4,18 J
1Kcal = 4.18KJ
Vedi alcuni esempi:
Esempio 1: trasformiamo 2600 Kcal in KJ.
Poiché 1 Kcal equivale a 4,18 KJ, usa la seguente regola del tre:
1 Kcal 4,18 KJ
2600 Kcal x
x.1 = 2600.4.18
x = 10868 KJ
unità di tempo
Tempo (h);
Minuto (min);
Secondo(i) [unità]standard di tempo stabilito dal SI].
Per convertire un'unità in un'altra, segui queste relazioni:
1h = 60 min
1 min = 60 s

Relazione tra unità di tempo
→ Conversione di unità di tempo
Esempio 1: trasformiamo 6 h in secondi.
Poiché 1 ora equivale a 3600 secondi (il risultato della moltiplicazione 60x60 della differenza tra ore e secondi), basta impostare la seguente regola del tre:
1 ora 3600 secondi
6h x
x.1 = 6.3600
x = 21600 s
Esempio 2: trasformiamo 600 s in minuti.
Poiché 1 minuto equivale a 60 s, basta usare la seguente regola del tre:
1 minuto 60 secondi
x 600 secondi
x.60 = 600
x = 600
x = 600
60
x = 10 min
Mol (quantità di materia)
È l'unità che stabilisce la quantità di entità (atomi, ioni, elettroni, neutroni, molecole) che formano una data materia. Secondo Amedeo Avogadro, 1 mole di qualsiasi materia contiene 6.02.1023 entità.
Esempio: 1 mole di H2O.
Una mole della sostanza acquosa ha:
6,02.1023 molecole d'acqua;
3.6,02.1023 atomi (il 3 è il risultato della somma di 1 ossigeno e 2 idrogeni);
2.6,02.1023 atomi di idrogeno;
1.6,02.1023 atomi di ossigeno.
Di Me. Diogo Lopes Dias

