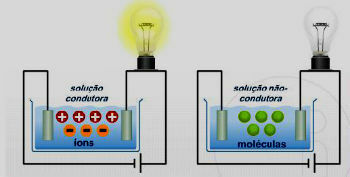
Salah satu cara unsur-unsur kimia diatur adalah melalui keluarga, yang sesuai dengan urutan vertikal dari tabel periodik.
Di 18 kolom dari tabel mengelompokkan unsur-unsur menurut kesamaan sifat kimia.
Pengorganisasian unsur-unsur kimia ke dalam keluarga adalah cara praktis untuk menyusun berbagai informasi yang ditemukan dan menyajikannya dengan cara yang sederhana.
Untuk memudahkan lokasi unsur kimia, keluarga ditunjuk dalam angka dari 1 hingga 18 sebagai berikut:
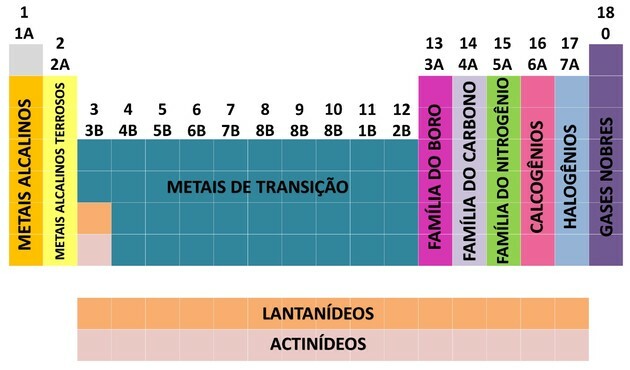
Melalui kontribusi banyak ilmuwan dan berbagai upaya untuk mengatur data, tabel periodik berkembang, menetapkan urutan untuk mengatur unsur-unsur.
Nomenklatur keluarga
- Keluarga dalam tabel dibagi menjadi A (perwakilan) dan B (transisi), yang diidentifikasi dengan huruf dan angka.
- Kamu elemen perwakilan keluarga 0, 1A, 2A, 3A, 4A, 5A, 6A dan 7A sesuai.
- Kamu elemen transisi keluarga 1B, 2B, 3B, 4B, 5B, 6B, 7B dan 8B sesuai.
- Dengan penentuan International Union of Pure and Applied Chemistry (IUPAC), keluarga diidentifikasi dalam: kelompok dari 1 hingga 18.
Tabel Periodik dan Distribusi Elektronik
Kesamaan antara unsur-unsur dari keluarga yang sama terjadi karena jumlah elektron valensi atom dalam keadaan dasar sama untuk anggota golongan tertentu.
Sebagai contoh:
| Grup 1 | Distribusi elektronik |
|---|---|
| 3Baca | 2-1 |
| 11Di | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
Atom golongan 1 memiliki elektron yang terdistribusi pada lebih dari satu tingkat energi, tetapi semua memiliki elektron valensi.
Dengan itu, kami mengamati bahwa membuat distribusi elektronik atom dalam keadaan dasar, kita menemukan posisinya pada tabel periodik.
elemen perwakilan
Elemen representatif menunjukkan perilaku kimia yang relatif kurang kompleks daripada elemen transisi dan membentuk sebagian besar zat di sekitar kita.
Beberapa keluarga elemen perwakilan diberi nama khusus, seperti yang ditunjukkan di bawah ini:
Kelompok |
Keluarga | nama tertentu | Nama asal | Elemen | konfigurasi elektronik |
|---|---|---|---|---|---|
| 1 | 1A | logam alkali | dari bahasa latin alkali, yang berarti "tanaman abu-abu". | Li, Na, K, Rb, Cs dan Fr | kami1 |
| 2 | 2A | logam alkali tanah | Istilah "duniawi" mengacu pada "ada di bumi". | Be, Mg, Ca, Sr, Ba dan Ra | kami2 |
| 13 | 3A | keluarga boron | Nama elemen pertama dari keluarga. | B, Al, Ga, In, Tl dan Nh. | kami2np1 |
| 14 | 4A | keluarga karbon | Nama elemen pertama dari keluarga. | C, Si, Ge, Sn, Pb dan Fl. | kami2np2 |
| 15 | 5A | keluarga nitrogen | Nama elemen pertama dari keluarga. | N, P, As, Sb, Bi dan Mc. | kami2np3 |
| 16 | 6A | Kalkogen | dari yunani khalk, karena mereka adalah elemen yang ditemukan dalam bijih tembaga. | O, S, Se, Te, Po dan Lv. | kami2np4 |
| 17 | 7A | halogen | Ungkapan Yunani yang berarti pembentuk garam. | F, Cl, Br, I, At dan Ts. | kami2np5 |
| 18 | 0 | Gas mulia | Itu dianggap tidak bereaksi dengan zat lain. | Dia, Ne, Ar, Kr, Xe, Re dan Og. | 1 detik2 (Dia) atau kita2np6 |
Melalui tabel, kita dapat melihat bahwa:
- Unsur-unsur yang disajikan di atas diklasifikasikan sebagai perwakilan karena mereka memiliki elektron paling energik di sublevel s atau p.
- Elektron didistribusikan di atas tingkat energi dan n mewakili tingkat terluar atom dalam keadaan dasar.
- Unsur-unsur perwakilan menurut rekomendasi IUPAC termasuk dalam kelompok atau famili 1,2,13,14,15,16,17 dan 18.
HAI hidrogen itu diklasifikasikan terpisah dari elemen lainnya. Bahkan dengan konfigurasi elektronik 1s1, dia bukan bagian dari kelompok 1 karena menampilkan perilaku tunggal.
elemen transisi
Unsur-unsur transisi sesuai dengan golongan 3 sampai 12. Mereka menerima nama ini karena mereka memiliki karakteristik antara antara kelompok 1 dan 2 dan perwakilan elemen non-logam.
Kamu logam transisi didefinisikan oleh IUPAC sebagai:
Elemen transisi memiliki sublevel d yang tidak lengkap atau dapat membentuk kation dengan sublevel d yang tidak lengkap.
Ketika elektron atom yang paling energik dalam keadaan dasar berada dalam sublevel d yang tidak lengkap, ini ditandai sebagai transisi eksternal.
Lantanida dan aktinida adalah elemen transisi internal karena mereka memiliki setidaknya satu sublevel f yang tidak lengkap.
Ketika unsur-unsur memiliki elektron yang mengisi orbital d atau f, mereka menunjukkan sifat yang sama dan dapat diklasifikasikan ke dalam unsur-unsur transisi luar atau dalam.
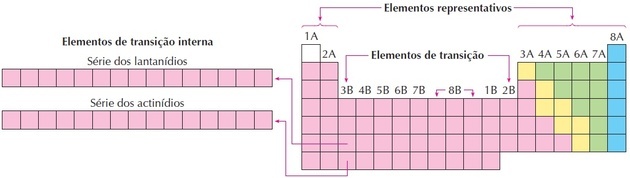
Seperti yang bisa kita lihat pada gambar, keluarga 8B sesuai dengan 3 kolom, mereka adalah kelompok 8, 9 dan 10, yang dikelompokkan seperti ini karena memiliki karakteristik yang sama.
Ciri-ciri utama keluarga
Tabel di bawah ini menunjukkan sifat-sifat utama golongan dalam tabel periodik:
| Kelompok | fitur | senyawa senyawa lebih umum |
kejadian |
|---|---|---|---|
| 1 | Padat dan mengkilap dalam kondisi sekitar. Penghantar listrik yang sangat reaktif, lunak dan baik. | Garam, hidroksida dan oksida |
Bereaksi dengan halogen dan membentuk garam. |
| 2 | Kurang reaktif dan lebih keras dari grup 1. Padatan perak dengan konduktivitas yang baik. | Garam, hidroksida dan oksida |
Membentuk garam dan oksida. |
| 3 sampai 12 | Mereka membentuk kompleks. Mereka adalah padatan logam, keras dan rapuh, dengan pengecualian merkuri, yang merupakan cairan. | Garam, oksida dan kompleks. Contoh: AgNO3, TiO dan [Cr(OH)3(H2HAI)3] |
Dalam mineral dalam bentuk oksida. |
| 13 | Padatan dalam kondisi sekitar, perak, kecuali boron. | Oksida Contoh: B2HAI3 |
Dalam mineral dalam bentuk oksida. |
| 14 | Padat dalam kondisi lingkungan. | Atom C dan Si dapat menyusun dirinya sendiri dalam rantai dan menghasilkan berbagai macam zat. | Dalam organisme hidup dan dalam bentuk silikat atau oksida. |
| 15 | Padatan, kecuali nitrogen, yang berwujud gas dalam kondisi sekitar. | Oksida dan asam Contoh: TIDAK2 dan H3DEBU4 |
Atmosfer, organisme hidup, dan mineral. |
| 16 | Padatan, kecuali oksigen, yang berwujud gas dalam kondisi sekitar. | Sulfida dan oksida Contoh: ZnS dan SiO2 |
Atmosfer, organisme hidup, dan mineral. |
| 17 | Mereka membentuk molekul diatomik dan sangat reaktif. Mereka adalah konduktor listrik dan panas yang buruk. Mereka agresif terhadap makhluk hidup dan lingkungan. | Asam dan Garam. Contoh: HCl dan KBr |
Ada dalam zat organik dan mineral. |
| 18 | Mereka sangat stabil dan ditemukan dalam bentuk gas. | Mereka hampir tidak membentuk zat senyawa. | Gas di atmosfer. |
Sifat kimia dan fisik membedakan satu keluarga dari yang lain. Seperti yang telah kita lihat, sifat kimia berhubungan dengan elektron dari valensi, dan melalui mereka, sebuah atom berinteraksi dengan yang lain, bertanggung jawab atas perilaku kimia dan ikatan kimia terbentuk.
Sifat fisika unsur-unsur dalam golongan yang sama dapat berbeda-beda menurut nomor atom dan massanya.
Latihan
Sekarang setelah Anda mengetahui lebih banyak tentang keluarga Tabel Periodik, uji pengetahuan Anda dan lihat apa yang telah Anda pelajari.
1) Perhatikan kutipan berikut dari Tabel Periodik.
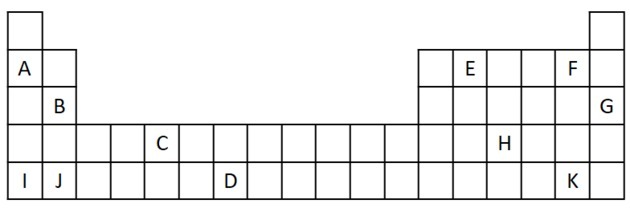
a) Sebutkan dua unsur yang memiliki dua elektron valensi.
b) Tunjukkan unsur yang bereaksi hebat dengan air, menghasilkan logam hidroksida.
c) Tunjukkan elemen non-reaktif.
d) Tunjukkan dua unsur yang bergabung dengan logam alkali untuk membentuk garam.
Balasan:
a) B dan J
Dua elektron valensi sesuai dengan golongan 2, yang memiliki konfigurasi elektron ns2 dan diwakili dalam latihan oleh B dan J.
b) A, B, I atau J.
A dan saya mewakili elemen keluarga 1; B dan J berasal dari keluarga 2. Seperti yang kita lihat pada tabel properti, unsur golongan 1 dan 2 sangat reaktif dan dapat membentuk hidroksida, seperti pada contoh yang diberikan: KOH dan Mg (OH)2.
c) G
Gas mulia sangat stabil dan karenanya tidak terlalu reaktif. Huruf G dimasukkan ke dalam tabel sebagai elemen dari keluarga ini.
d) F dan K
Halogen bereaksi dengan logam alkali membentuk garam. Contoh paling umum dari ini adalah garam meja, NaCl.
2) Gambar berikut menunjukkan tiga unsur kimia, dari kiri ke kanan, litium, natrium, dan kalium.

Pilih opsi yang melengkapi setiap pernyataan berikut dengan benar.
1.1) "Kita dapat mengatakan bahwa litium, natrium, dan kalium...
(A) … termasuk dalam periode yang sama.”
(B) …memiliki nomor atom yang sama.”
(C) … termasuk dalam kelompok yang sama.”
(D) …memiliki nomor massa yang sama.”
1.2) "Elemen litium, natrium dan kalium...
(A) …memiliki sifat kimia yang sangat mirip.”
(B) …memiliki sifat kimia yang sangat berbeda.”
(C) … adalah non-logam.”
(D) … bereaksi dengan air untuk membentuk larutan asam.”
Jawaban:
1.1) (C) termasuk dalam kelompok yang sama.
1.2) (A) memiliki sifat kimia yang sangat mirip.
Kita dapat memperoleh informasi ini dengan melihat tabel periodik atau dengan membuat distribusi elektronik dari unsur litium, natrium dan kalium. Kita akan melihat bahwa ketiganya memiliki elektron di kulit valensi dan karena mereka adalah bagian dari kelompok yang sama, sifat kimianya sangat mirip.
3) Perhatikan tabel berikut, di mana nomor atom dan distribusi elektronik dari beberapa unsur kimia diwakili.
| Elemen | simbol kimia | nomor atom | Distribusi elektronik |
|---|---|---|---|
| Litium | Baca | 3 | 2,1 |
| Berilium | menjadi | 4 | 2,2 |
| Fluor | F | 9 | 2,7 |
| neon | Hah | 10 | 2,8 |
| klorin | Cl | 17 | 2,8,7 |
| argon | Udara | 18 | 2,8,8 |
| Kalium | K | 19 | 2,8,8,1 |
| Kalsium | Sini | 20 | 2,8,8,2 |
Tunjukkan kelompok setiap elemen.
Balasan:
Litium dan kalium: golongan 1. (Mereka memiliki elektron di kulit valensi).
Berilium dan kalsium: kelompok 2. (Mereka memiliki dua elektron di kulit valensi).
Fluor dan klorin: golongan 17. (Mereka memiliki tujuh elektron di kulit valensi).
Neon dan argon: kelompok 18. (Mereka memiliki delapan elektron di kulit valensi).
Periksa pertanyaan ujian masuk dengan resolusi komentar di Latihan pada Tabel Periodik dan pertanyaan yang tidak dipublikasikan tentang subjek di Latihan Pengorganisasian Tabel Periodik.