ITU Hukum Kecepatan Reaksi menghubungkan kecepatan transformasi kimia dengan konsentrasi pereaksi dalam jumlah materi (mol/L), yang dapat dinyatakan sebagai berikut:

Sebagai contoh, perhatikan reaksi umum berikut:
aA + bB → cC + dD
Katakanlah kita meningkatkan konsentrasi reaktan A dan B, apa yang akan terjadi pada kecepatan reaksi? Nah, karena jumlah partikel reaktan akan meningkat di ruang yang sama, akan ada tumbukan yang lebih efektif di antara mereka, yang akan menghasilkan peningkatan laju perkembangan reaksi. Yang berarti itu akan meningkatkan kecepatan Anda.
Oleh karena itu, laju reaksi berbanding lurus dengan konsentrasi reaktan. Namun, itu tergantung pada suhu juga. Oleh karena itu, kami memiliki persamaan matematika berikut yang mewakili hukum kecepatan reaksi:

Tentang apa:
v = kecepatan reaksi;
k = konstanta yang hanya bergantung pada nilai temperatur;
dan = eksponen yang ditentukan secara eksperimental.
Hanya jika reaksi bersifat elementer, yaitu terjadi dalam satu langkah, eksponennya sama persis dengan koefisien persamaan kimia yang seimbang:
v = k. [ITU]Itu. [B]B. Namun, dalam kasus lain, potensi yang sesuai untuk menaikkan konsentrasi setiap reagen harus ditentukan secara eksperimental.Jangan berhenti sekarang... Ada lagi setelah iklan ;)
Hukum kelajuan reaksi memiliki banyak nama, berikut beberapa di antaranya: Hukum Aksi Massa, Persamaan Kecepatan, Hukum Kinetik Reaksi dan Hukum Guldberg-Waage.
Perhatikan contoh bagaimana menerapkan hukum ini:
Perhatikan reaksi elementer berikut:
2 HCl (g) → H2 (g) + Cl2 (g)
a) Tulis persamaan untuk kecepatan reaksi ini;
b) Melalui percobaan, kecepatan reaksi dekomposisi gas hidrogen klorida dan konsentrasi reagen ini, pada suhu konstan 25 °C, dicatat dalam tabel di bawah ini:
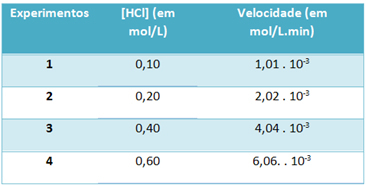
Berdasarkan ini, tentukan konstanta kecepatan karakteristik reaksi ini pada suhu tersebut.
Resolusi:
Itu) v = k. [HCl]2
b) v = k. [HCl]2
k = __v___
[HCl]2
k = 1,01. 10-3 mol L-1. min-1
0,01 mol. L-1
k = 1,01. 10-1 min-1
Untuk menyelesaikan huruf "b", Anda dapat menggunakan data dari salah satu eksperimen yang nilainya akan sama.
Tetapi bagaimana jika reaksinya tidak mendasar? Bagaimana mungkin untuk menyelesaikan pertanyaan seperti ini dalam reaksi non-dasar? Untuk mengetahui caranya, baca Hukum kecepatan untuk reaksi non-elementer.
Oleh Jennifer Fogaa
Lulus kimia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
FOGAÇA, Jennifer Rocha Vargas. "Hukum kecepatan reaksi kimia"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm. Diakses pada 27 Juni 2021.