A só hidrolízis erős savak és bázisok között akkor fordul elő, amikor a sóban lévő kation nem lép kölcsönhatásba a vízben lévő anionnal, és a sóban lévő anion nem lép kapcsolatba a vízben lévő kationnal. A só és víz kationjai és anionjai közötti hidrolízis csak akkor következik be, ha a képződött termék gyenge sav, gyenge bázis vagy mindkettő. Értse meg az erős savak és az erős bázisok közötti só hidrolízist lépésről lépésre:
a) 1. lépés: vízionizáció
A víz olyan anyag, amely képes szenvedni autoionizációazaz hidronium-kationt termel (H+) és hidroxid-anion (OH-) szerkezetéből.
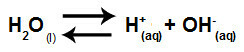
A víz önionizációját képviselő egyenlet
b) 2. lépés: Elhatárolódás sót
Ha egy sót adunk a vízhez, az a disszociáció folyamatán megy keresztül. Mivel a só ionos vegyület a vízben, kationjai és anionjai felszabadulnak a közegbe, az alábbiakban bemutatott egyenlet szerint:
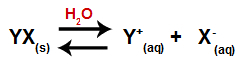
Bármely só disszociációját képviselő egyenlet
c) 3. lépés: Erős savak és bázisok só hidrolízise
Erős sav esetén: amikor a só anionja kombinálva a H-val+ vizet HCl, HBr, HI vagy más sav képződéséhez, amelyben az oxigének számának a hidrogénszámmal történő kivonása egyenlő vagy nagyobb, mint 2, akkor egy
erős sav. Ezért az említett ionok kombinációja nem fordul elő.Az erős alapozáshoz: amikor az IA (alkálifémek) vagy IIA (alkáliföldfémek, a magnézium kivételével) családba tartozó só kationját kombinálják az OH-val- vízből, akkor a erős alap. Ezért az említett ionok kombinációja nem fordul elő.
Amikor a sóionok nem lépnek kölcsönhatásba a vízionokkal, a következő egyenlet áll rendelkezésünkre:
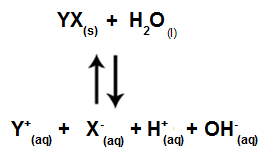
Az egyenlet az összes oldatban jelenlévő iont mutatja
Összefoglalva, mivel a sóionok nem lépnek kölcsönhatásba a vízionokkal, a sóionok nem mozdítják elő a végső oldat változását. Így az erős savak és erős bázisok közötti sóhidrolízis egyenletét csak a vízionizációs egyenlettel írhatjuk fel.
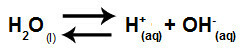
Erős savak és bázisok hidrolízisét bemutató egyenlet
d) Példa az erős savak és bázisok közötti só hidrolízisére
Amikor hozzáadjuk a kálium-klorát sót a vízhez (KClO3), a só disszociál és felszabadítja a káliumkationt (K+) és a klorát-anion (ClO3-) középen.
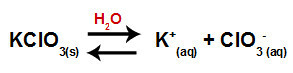
Disszociációs egyenlet kálium-klorátra
Fontos megjegyezni, hogy a víz önionizálódik, és a közeget hidronium-kationnal látja el (H+) és hidroxid-anion (OH-). Most fel kell mérnünk a só és a vízionok kölcsönhatását.
Amikor a H+ kölcsönhatásba lép a ClO-val3-, perklórsavat (HclO3). Mivel az oxigének számának kivonása a perklórsav ionizálható hidrogénjeinek számával 2, ezért erős. Ezért az ionok közötti kölcsönhatás nem következik be.
Amikor a K kation+ kölcsönhatásba lép az OH anionjával-, erős bázis képződik, mivel a kálium alkálifém. Ezért az ionok közötti kölcsönhatás nem következik be.
Az egyenlet, amely az erős savak és bázisok közötti só hidrolízist képviseli a kálium-klorát vízben történő oldódása során:
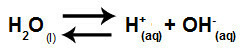
A kálium-klorát-hidrolízis kémiai egyenlete
Általam. Diogo Lopes Dias
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm