Hőrejtett az összege energiatermikus amelyet egy test vagy termodinamikai rendszer abszorbeál vagy felad, fizikai állapotának változása során, ban ben állandó hőmérséklet.
Amikor egy tiszta anyag eléri a hőmérsékletét Fúzió vagy forró, a bemelegítés során a fizikai állapota megváltozni kezd. Ennek során továbbra is elnyeli a hőt, azonban hőfokmaradványokállandó. Ez azért történik, mert ezeknek a hőmérsékleteknek az elérésekor, amelyekben a fizikai állapot megváltozik, a termodinamikai rendszer által elnyelt összes hő felhasználásra kerül a energialehetséges amely együtt tartja a molekuláit. Amint a termodinamikai rendszer elnyeli a molekulák felbomlásához szükséges összes energiát, csökken a kölcsönhatás közöttük, jelezve, hogy aggregációs állapotuk megváltozott. A fizikai állapot megváltozása után az elnyelt hő izotermikusan a molekulák továbbra is felszívódnak, biztosítva őket energiakinetika. Ezt a fajta hőt, amely növeli a molekulák mozgási energiáját, ún érzékelhető hő.
Nézis: Hét „arany” tipp a hatékonyabb fizika tanulmányhoz
O hőrejtett méri a hőmennyiséget tömegegységre vonatkoztatva, ami szükséges a hőmérséklet változásához a test fizikai állapota, tehát mértékegysége a Nemzetközi Rendszer szerint (SI), a Jouleperkilogramm (J / kg). Más egységek, például a kalóriapergramm (cal / g), elég gyakori a kalorimetria vizsgálatában.
A látens hő típusai
Kétféle hő létezik: o hőhaszint ez a hőrejtett. Érzékeny hő az, ami a testek között átadódik, ha hőmérsékletváltozások vannak. A látens hő viszont akkor fordul elő, ha hőátadás történik hőmérsékletváltozás nélkül.
A látens hő megváltozik a fizikai állapot különböző változásai miatt. Nézze meg a látens hő különböző típusait:
látens hőban benegyesülés (LF): ez a hő, amelyet a testek a fúziós folyamat során elnyelnek vagy leadnak: folyadéktól szilárdig és fordítva, állandó hőmérséklet mellett.
látens hőban benpárolgás (LV): az, amely szilárd-folyadék vagy folyadék-szilárd átalakulások során kerül átadásra, ban ben állandó hőmérséklet.
Nézis: Mi a hőteljesítmény?
Példákban benhőrejtett
Nézzen meg néhány mindennapi helyzetet, amelyben látens hőcserék vannak:
Amikor a vizet 100 ° C-os hőmérsékletre melegítjük, elindul a párolgási folyamat. Amíg az összes víz nem válik gőzzé, addig a hőmérséklete nem változik.
Amikor vizet öntünk egy nagyon forró felületre, az összes víz szinte azonnal elpárolog. Ezt a folyamatot fűtésnek hívják, és a látens hő elnyelésével jár.
Látens hőcsere van, amikor alacsony hőmérsékleten és minden tartalmához hozzáérünk egy üdítőpalackhoz a víz olvadáspontjánál alacsonyabb hőmérsékletének köszönhetően állandó hőmérsékleten gyorsan megfagy.
látens hő képlet
A látens hőt az izoterm átalakulás során átvitt hőmennyiség arányával számolják:
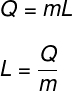
Q - az átadott hő mennyisége
m - testtömeg
L - látens hő
Fázisváltozások és látens hő
A tiszta anyagokban fázisváltozások lépnek fel ban benhőfokállandó, a látens hő elnyelésével vagy felszabadításával. Minden tiszta anyagnak van egy fűtési görbe hasonló az alábbi képhez:
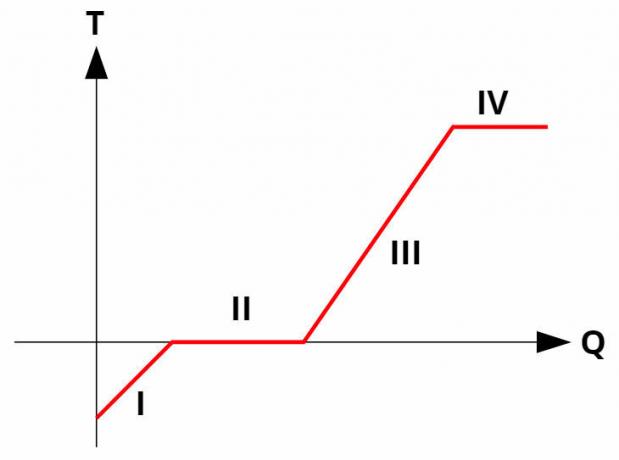
Nál nél görbékban benfűtés a hőmérsékletet (y tengely) viszonyítják a megadott vagy kapott hőmennyiséghez (x tengely). A fázisváltozásoknál (II. És IV. Folyamat) a hőmérséklet állandó marad, bár továbbra is van hőcsere.
Lásd még: A kalorimetria alapjai
látens hőasztal
Normál körülmények között hőfok és nyomás, O hőrejtett A víz fizikai állapotának különböző változásai miatt az alábbi táblázat mutatja:
átalakítás |
Látens hő (cal / g) |
Fúzió (0 ° C) |
80 |
Szilárdulás (0 ° C) |
-80 |
Párolgás (100 ° C) |
540 |
Páralecsapódás (100 ° C) |
-540 |
A fenti táblázat szerint 80kalória befagyasztására 1 grammvíz olvadásponton (0 ° C). A negatív jelek a folyamatai megszilárdulás és páralecsapódás jelzik, hogy hő szabadult fel bennük, tehát ez a két átalakulás hőtermelő. Az alábbi táblázat a látens hőt mutatja be J / kg, ugyanazokra a folyamatokra:
átalakítás |
Látens hő (J / kg) |
Fúzió (0 ° C) |
333.103 |
Szilárdulás (0 ° C) |
-333.103 |
Párolgás (100 ° C) |
2,2.106 |
Páralecsapódás (100 ° C) |
-2,2.106 |

látens hőgyakorlatok
1) Egy tartály 500 g folyékony vizet tartalmaz. A víz hőmérsékletének változása nélkül az összes tartalma hirtelen elpárolog. Határozza meg, hogy mennyi hő jutott át a tartály tartalmába.
Adatok: LF = 540 cal / g
Felbontás:
A víz tömegének elpárologtatásához szükséges hőmennyiség kiszámításához a következő képletet használjuk:
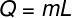
A gyakorlat által szolgáltatott adatok felhasználásával a következő számítást hajtjuk végre:
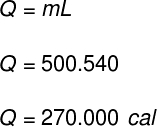
Általam. Rafael Helerbrock