Jedan miješanje otopina iste otopljene tvari bez kemijske reakcije sastoji se od spajanja dvije otopine u istom spremniku s, na primjer, kalijevim kloridom (Kcl). U ovoj vrsti smjese nikada neće doći do kemijske reakcije zbog prisutnosti jednakih otopljenih tvari, odnosno obje imaju isti kation i isti anion. Dakle, možemo reći da kada izvodimo smjesu s tim karakteristikama, samo dodajemo količine otopljene tvari i otapala koje čine obje otopine.
Ako pomiješamo, na primjer, otopinu od 1L vode i 4 grama KI (kalijev jodid) s drugom otopinom od 2L vode i 6 grama KI, dobit ćemo novu otopinu od 3L vode i 10 grama KI .
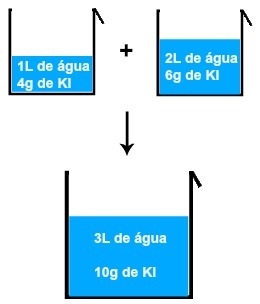
Rezultat miješanja dviju otopina kalijevog jodida
Analizirajući sliku, možemo to zaključiti masa otopljene tvari (m1') prve otopine dodaje se masi otopljene tvari (m1'') drugog rješenja, što rezultira masom otopljene tvari (mF) u konačnom rješenju (Miješati):
m1'+ m1'' = mF
U primjeru:
4 + 6 = 10 grama
Isto se događa s volumenom vode prisutne u svakoj otopini, odnosno volumen prvog (V ') dodan volumenu drugog (V' ') rezultira konačnim volumenom (V'F):
V '+ V' '= VF
U primjeru:
1 + 2 = 3 L
Kako svaka otopina ima količinu otopljene otopljene tvari, ovdje imamo mješavinu otopine iste otopljene tvari, tada možemo, iz gore navedenog, odrediti koncentraciju (zajedničku, molarnost) svake od miješanih otopina i također konačne otopine.
Stoga se moramo sjetiti formula za izračunavanje ovih koncentracija:
Uobičajena koncentracija:
C = m1
V
m1 = masa otopljene otopine
V = volumen otopine
BILJEŠKA: izoliranje m1 u formuli imamo: m1 = Životopis
Molarnost:
M = m1
M1.V
M1 = molarna masa otopljene tvari.
BILJEŠKA: izoliranje m1 u formuli imamo: m1 = M.M1.V
Kako se smjesa otopina iste otopljene tvari odnosi na zbroj mase otopljene otopine, možemo zamijeniti svako zapažanje u sljedećem izrazu:
m1'+ m1'' = mF
C'.V '+ C' '. V' '= CF.VF
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
C '= uobičajena koncentracija otopine 1
C '' = uobičajena koncentracija otopine 2
Ako izračun smjese otopina uključuje molarnost:
m1'+ m1'' = mF
M'.V '+ M' '. V' '= MF.VF
BILJEŠKA: Budući da je otopljena tvar ista, molarna masa je ista u svakoj od otopina; stoga se u izračunu zanemaruje.
sad vidi primjeri koji obuhvaćaju proračune u smjesi otopine iste otopljene tvari bez kemijske reakcije:
Primjer 1: (Mackenzie-SP-Adaptada) Dodavanjem 600 ml otopine 14 g / L KOH u određeni volumen (v) otopine 84 g / L iste baze, dobije se otopina od 67,2 g / L. Dodani volumen (v) otopine 84 g / L je:
a) 0100 ml
b) 3000 ml
c) 2700 ml
d) 1500 ml
e) 1900 ml
Podaci dobiveni vježbom bili su:
V '= 600 ml
C '= 14 g / L
V '' =?
C '= 84 g / L
VF = ?
CF = 67,2 g / L
Prije određivanja dodanog volumena otopine 1, u početku moramo odrediti konačni volumen pomoću sljedećeg izraza:
V '+ V' '= VF
600 + V '' = VF
Zamjenjujući vrijednosti dane u donjem matematičkom izrazu, imamo:
C'.V '+ C' '. V' '= CF.VF
14. 600 + 84.V '' = 67.2. (600 + V '')
8400 + 84.V '' = 67,2. 600 + 67,2.V ''
8400 + 844.V '' = 40320 + 67.2.V ''
84.V '' - 67.2.V '' = 40320 - 8400
16.8.V '' = 31920
V '' = 31920
16,8
V '' = 1900 ml
Primjer 2: (UFOP) U odmjernu tikvicu od 1000 ml, dodano je 250 ml 2M otopine sumporne kiseline s 300 ml 1M otopine iste kiseline i količina je dodana destiliranom vodom do 1000 ml. Odredite molarnost dobivene otopine.
Podaci dobiveni vježbom bili su:
V '= 250 ml
M '= 2 M
V '' = 300 ml
M '= 1 M
VF = 1000ml
MF = ?
Da biste odredili molarnost konačnog rješenja, samo upotrijebite matematički izraz koji predstavlja postupak:
M'.V '+ M' '. V' '= MF.VF
2. 250 + 1. 300 = MF.1000
500 + 300 = MF. 1000
800 = MF
1000
MF = 0,8 mol / L
Ja, Diogo Lopes Dias
Želite li uputiti ovaj tekst u školu ili u akademsko djelo? Izgled:
DANI, Diogo Lopes. "Smjesa otopina iste otopljene tvari bez kemijske reakcije"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/mistura-solucoes-mesmo-soluto-sem-reacao-quimica.htm. Pristupljeno 27. lipnja 2021.