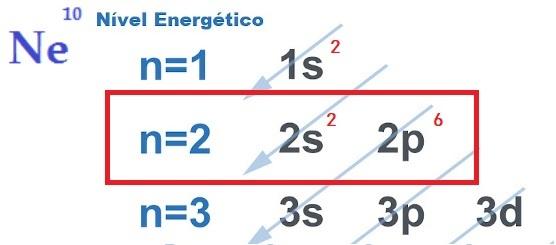
Na kemijske veze su interakcije koje se javljaju između atoma i postaju molekula ili osnovna tvar spoja. Postoje tri vrste poveznica: kovalentni, metalni i ionska. Atomi se stvaranjem kemijske veze nastoje elektronički stabilizirati. Taj se postupak objašnjava s teorija okteta, koji nalaže da svaki atom, da bi postigao stabilnost, mora imati osam elektrona u svojoj valentnoj ljusci.
Kemijske veze i pravilo okteta
THE potraga za elektroničkom stabilnošću, što opravdava ostvarivanje kemijskih veza između atoma, objašnjava se s teorija okteta. Predložio Newton Lewis, ova teorija navodi da se atomska interakcija događa tako da svaki element stekne stabilnost plemenitog plina, tj. osam elektrona u valentni sloj.
Za ovo, element dati, primiti ili podijeliti elektroni iz njegove najudaljenije ljuske, stvarajući tako kemijske veze ionskog, kovalentnog ili metalnog karaktera. Vas plemeniti plinovi oni su jedini atomi koji već imaju osam elektrona u svojoj najudaljenijoj ljusci i zato ne reagiraju previše s drugim elementima.
Izgledtakođer: Pravila elektroničke distribucije: kako to učiniti?
Vrste kemijskih veza
Da bi dobili osam elektrona u valentnoj ljusci kako je predviđeno u pravilu okteta, atomi se povezuju, koji se razlikuju ovisno o potrebi doniranja, primanja ili dijeljenja elektrona, kao i o prirodi vezanih atoma.
ionske veze
Također poznat kao elektrovalentne ili heteropolarne veze, dogoditi se između metali i vrlo elektronegativni elementi (ametali i vodik). U ovoj vrsti poziva, metali imaju tendenciju da gube elektrone, pretvarajući se u katione (pozitivne ione), a nemetali i vodik dobivaju elektrone, postajući anioni (negativni ioni).
Vas ionski spojevi su tvrde i lomljive, imaju visoku točku vrenja i ponašanje električna struja kad su u tekućem stanju ili razrijeđeni u vodi.
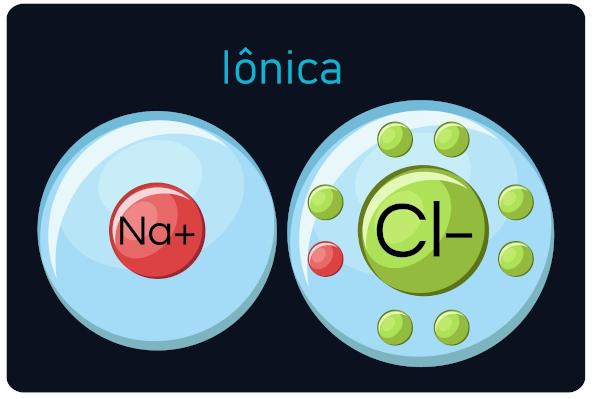
Promatranje: Budite svjesni da će atom koji dobije elektrone postati ion s negativnim predznakom i da atom koji izgubi elektrone postane pozitivan predznak.
Primjeri ionskih tvari:
- Bikarbonat (HCO3-);
- Amonij (NH4+);
- Sulfat (SO4-).
Da biste saznali više o ovoj vrsti kemijske veze, posjetite naš tekst: ionske veze.
kovalentne veze
Na kovalentne veze dogoditi se po dijeljenje elektrona. Zbog male razlike u elektronegativnosti između veznih elemenata oni ne doniraju i ne primaju elektrone, već dijeliti elektroničke parove tako da su stabilni prema pravilu okteta. Ova vrsta veze vrlo je česta u jednostavnim elementima poput Cl2, H2, O2, a također i u lancima ugljika. razlika od elektronegativnost između liganada određuje je li veza polarna ili nepolarna.

Pročitajte i vi:Polarnost molekula: kako prepoznati?
dativna kovalentna veza
Također se zove koordinatna kovalentna veza, polupolarna, dativna ili koordinatna veza, vrlo je slična kovalentnoj vezi, razlika između njih dvije je u tome što je jedan od atoma u dativnoj vezi odgovoran za dijeljenje dva elektrona. U ovoj vrsti veze, to javlja se umjetno, molekula dobiva iste karakteristike kao molekula koja proizlazi iz spontane kovalentne veze.
Metalne karike
Ova vrsta veze događa se između metala, koji uključuju elemente obitelji 1A (alkalni metali), 2A (zemnoalkalijski metali) i prijelazni metali (blok B periodnog sustava - skupina 3 do 12), tvoreći ono što nazivamo metalne legure. Diferencijalna karakteristika u odnosu na druge vrste veza je kretanje elektrona, što objašnjava činjenicu da su metalni materijali, u čvrstom stanju, izvrsni električni i toplinski vodiči. Uz to, metalne legure imaju visoko talište i vrelište, duktilnost, podatnost i sjaj. Primjeri metalnih legura su:
čelik: željezo (Fe) i ugljik C;
bronca: bakar (Cu) + kositar (Sn);
mesing: bakar (Cu) + cink (Zn);
zlato: zlato (Au) + bakar (Cu) ili srebro (Ag).

Sažetak
- Kemijske veze: interakcija između atoma koji traže elektroničku stabilnost.
- Vrste poziva: ionska, kovalentna i metalna.
- Pravilo okteta: definira da, da bi atom bio stabilan, mora imati osam elektrona u svojoj valentnoj ljusci.
riješene vježbe
Pitanje 1 - (Mackenzie-SP) Da bi atomi sumpora i kalija dobili elektroničku konfiguraciju jednaku konfiguraciji plemenitog plina, potrebno je da:
(Podaci: atomski broj S = 16; K = 19).
a) sumpor prima 2 elektrona, a kalij 7 elektrona.
b) sumpor daje 6 elektrona, a kalij 7 elektrona.
c) sumpor daje 2 elektrona, a kalij 1 elektron.
d) sumpor prima 6 elektrona, a kalij 1 elektron.
e) sumpor prima 2 elektrona, a kalij 1 elektron.
Razlučivost
Alternativa E. Budući da je sumpor iz obitelji 6A ili 16, pokoravajući se pravilu okteta, on mora steći 2 elektrona da bi imao 8 u svojoj valentnoj ljusci. S druge strane, kalij, koji pripada prvoj obitelji periodnog sustava (1A ili obitelj vodika), da bi u svom valentnom sloju imao konfiguraciju plemenitog plina, treba izgubiti 1 elektron. Kombinacijom 2 atoma kalija s 1 atomom sumpora možemo uspostaviti ionsku vezu u kojoj su oba elementa električno stabilna.
pitanje 2 - (UFF) Majčino mlijeko je hrana bogata organskim tvarima, poput proteina, masti i šećera, te mineralnim tvarima kao što je kalcijev fosfat. Ti organski spojevi imaju glavnu karakteristiku kovalentne veze u stvaranju njihovih molekula, dok mineral također ima ionsku vezu. Provjerite alternativu koja ispravno predstavlja koncepte kovalentne, odnosno ionske veze:
a) Kovalentna veza javlja se samo u organskim spojevima.
b) Kovalentna veza vrši se prijenosom elektrona, a ionska veza dijeljenjem elektrona sa suprotnim spinovima.
c) Kovalentna veza nastaje privlačenjem naboja između atoma, a ionska veza razdvajanjem naboja.
d) Kovalentna veza nastaje spajanjem atoma u molekulama, a ionska veza spajanjem atoma u kemijskim kompleksima.
e) Kovalentna veza vrši se dijeljenjem elektrona, a ionska vezom prijenosom elektrona.
Razlučivost
Alternativa E.
Pogledajmo ostale:
- Alternativa: nepravilne se kovalentne veze javljaju i u anorganskim spojevima kao što je CO2.
- Alternativa b: netočna, jer kovalentne veze nastaju dijeljenjem, a ionske veze prijenosom elektrona.
- Alternativa c: I kovalentna i ionska veza nastaju zbog potrebe za gubljenjem ili dobivanjem elektrona, a ne zbog elektrostatičke privlačnosti između jezgri.
- Alternativa d: Obje veze, i kovalentne i ionske, nastaju spajanjem atoma u molekuli.
pitanje 3 - (PUC-MG) Pregledajte tablicu koja pokazuje svojstva triju tvari, X, Y i Z, u uvjetima okoline.
| Tvar | Temperatura topljenja (c °) | električna provodljivost | Topljivost u vodi |
| x | 146 | nijedna |
topljiv |
| g | 1600 | visoko | netopiv |
| z | 800 | samo rastopljena ili otopljena u vodi | topljiv |
Uzimajući u obzir ove podatke, TOČNO je tvrditi da su tvari X, Y i Z:
a) ionski, metalni, molekularni.
b) molekularni, ionski, metalni.
c) molekularni, metalni, ionski.
d) ionski, molekularni, metalni.
Razlučivost
Alternativa C.
Tvar X je molekularna, kao molekularne veze, zvane i kovalenti, imaju nisko vrelište, jer razlika u elektronegativnosti između liganada nije vrlo visoka. Općenito kovalentni spojevi nemaju električnu vodljivost, a topljivost je promjenjiva.
Tvar Y možemo prepoznati kao metalnu, jer metali imaju visoko talište, izvrsni su električni vodiči i netopivi su u vodi.
Napokon, supstanca Z je ionska, jer je talište relativno visoko za tu supstancu, što je posljedica kristalnog rasporeda molekule. Kada se ionska tvar otopi u vodi ili u tekućem stanju, ona ima slobodne ione, što je čini elektrovodljivom i topljivom u vodi.
Napisala Laysa Bernardes Marques
Učitelj kemije
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/ligacoes-quimicas.htm
